پیوند کووالانسی
میلیونها ماده مرکب شناخته شده فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4 ، 5 ، 6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آن ها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
تعریف پیوند کووالانسی
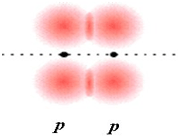
یک جفت الکترون مشترک بین دو هسته یک پیوند کووالانسی تشکیل میدهند.
استحکام پیوند کووالانسی
آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند.استحکام پیوند کووالانسی ناشی از جاذبه متفابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترون های مشترکی را جذب میکنند.

دو اوربیتال به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد طبق اصل طرد پاولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. در نتیجه تشکیل پیوند اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشود.
انواع پیوند کووالانسی
پیوند یگانه کووالانسی
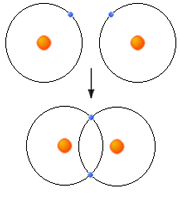
متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهای ازقبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند یک جفت الکترون حاصل میشود.

پیوند چند گانه
بین دو اتم ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول به وجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم پیش بینی کرد.

نماد ساختار مولکول
در ساختار اول، جفت الکترون مشترک با دو نقطه و ساختار دوم با یک خط کوتاه نشان داده شده است.
مانند :
پیوند یگانه
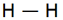
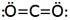
پیوند سه گانه
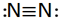


مسابقه وبلاگ برتر ماه
نظرات شما عزیزان:
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:






 آمار
وب سایت:
آمار
وب سایت:

