زنبور عسل Bee

در مقاله ی گذشته در رابطه با زنبور ها مطالبی آموختیم. در این مطلب به بررسی زنبور های عسل خواهیم پرداخت.
زنبورهای عسل مانند مورچگان جزو جانوران اجتماعی به حساب می آیند و مانند آن ها در ساختمان لانه و جمع آوری غذا و نگه داری لاروها با یکدیگر همکاری می کنند.
اگر چه زنبورهای عسل با زنبورهای زرد خویشاوندی دارند ولی تفاوت آن ها در این است که زنبورهای زرد لارو خود را با گوشت تغذیه می کنند در حالی که زنبورهای عسل از شهد و گرده گیاهان به نوزادان خود غذا می دهند.
در کلنی زنبورهای عسل، ملکه کندو را سرپرستی می کند.
ملکه پس از طی دوران دگردیسی از زنبورهای کارگر معمولی بزرگ تر است .
بقیه رقبای خود را نیش زده و می کشد و بعد از جفت گیری به کندو باز می گردد. با ورود ملکه جدید ملکه قبلی برای تشکیل کلنی جدید کند و به همراه تعدادی از زنبورهای کارگر را ترک می کند.
لانه حجره حجره بوده زنبورهای عسل از موم ساخته می شود حجره ها به صورت شش ضلعی است و روی ورقه ی از موم که با افق زاویه ی 90 درجه می سازد ساخته می شود.
فرآورده های زنبور عسل

عسل
عسل از قدیمی ترین شیرین کننده هایی است که مورد استفاده انسان بوده است و حاوی قندهای گلوکز، فروکتوز، مواد معدنی مثل منیزیم، پتاسیم، کلسیم، کلریدسدیم، گوگرد، آهن و فسفات است. در ضمن این که ویتامین هایی متفاوتی در آن دیده می شود.
عسل حاوی آنتی بیوتیک های متفاوتی است و علاوه بر املاح فوق، مواد معدنی دیگری نیز داراست.
موم
موم از غدد مخصوصی که در زیر شکم زنبورها قرار دارد ساخته می شوند. زنبورها موم را به هم پیوسته و شانه های معروفشان را می سازند. زنبور عسل شهد و دانه های گرده گل ها را جمع آوری کرده و از آن ها عسل می سازند.
زهر
زهر زنبور ترکیب بسیار پیچیده ای دارد و دست کم هشت نوع پروتئین در آن شناسایی شده است
مشخص شده است ترکیبات زهر رنبور عسل در مناطق مختلف و نسبت به فصل های مختلف با هم فرق می کند.
زهر از کیسه ای که در انتهای بدن زنبور قرار دارد ترشح می شود.
وقتی زنبور عسل فردی را نیش می زند زهر از کیسه زهر خالی شده وارد بدنش می گردد و باعث درد و سوزن فراوان می شود. چون نیش زنبور عسل خاردار است. این خارها در بدن فرد گیر کرده و بعد از گزش از بدنش جدا می گردد و روده اش که چسبیده به نیش است بیرون آمده و این زنبور می میرد.
بره موم (صمغ)
از فرآورده های مفید زنبور عسل است که مخلوطی از مقادیر مختلف موم زنبور وصمغ ( رزین ) گیاهانی است که با نشستن و برخاستن زنبور عسل روی آن ها، به ویژه از جوانه گل ها و برگ ها جمع آوری می شود. زنبورها، رزین های محافظ گل و برگ را با آرواره های خود می تراشند و همانند دانه گرده آن را روی ساق پاهای عقب خود در سبد گرده حمل می کنند. در حین جمع آوری بره موم، رزین ها، مقداری بزاق، سایر ترشحات زنبور عسل و هم چنین موم با آن مخلوط می گردند.
گفته می شود بره موم فواید متخلفی دارد از جمله ترمیم و نوسازی بافت ها،فعالیت های ضد باکتری و ...
ژله رویال
یا ژله شاهانه که غذای مخصوص ملکه تلقی می شود. و از غددی که در سر زنبور هستند ترشح می گردد. ژله رویال ارزش غذایی بسیار بالایی دارد.
شهد
شهد توسط خرطوم و دانه های گرده توسط مژه های ریز بدن زنبور جمع آوری می شوند .
در فواصل استراحت زنبورهای عسل دانه های گرده روی مژه های بدنشان را به داخل کیسه های گرده روی پاهای عقبی شان جمع می کنند. و بعد آن ها را به لانه برده با گرداندن در داخل دهانشان با بزاق آغشته و به عسل تبدیل می کنند.
بعد از ساخته شدن عسل آن را داخل حجره ها قرار داده و روی آن را به وسیله یک لایه موم می پوشانند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
عنکبوت ها
بیش تر ما کما بیش عنکبوت ها را می شناسیم آن ها در جاهای مختلفی یافت می شوند. خانه ها، خرابه های متروکه و جنگل ها، باغ ها و ... و تقریباً در تمام نقاط کره زمین یافت می شوند. بنابراین در هر وضعیت آب و هوایی قادر به سکونت هستند.
بیش از هزاران نوع عنکبوت در نقاط مختلف جهان شناخته شده است که اندازه های بسیار گوناگونی دارند. کوچک ترین آن ها از یک دانه ی برنج ریزتر و بزرگ ترین آن ها از کف دست ما بزرگ تر است.
آن ها بیش تر از حشرات تغذیه می کنند. اما بعضی از آن ها از عنکبوت های کوچک تر قورباغه ها و حتی ماهی ها به عنوان غذایی لذیذ استفاده می کنند.
بدن عنکبوت از دو قسمت اصلی تشکیل شده است.
 سر و قفسه سینه
سر و قفسه سینه شکم
شکمدر جلوی سر سینه یک جفت اندام استوانه ای وجود دارد که یک نیش در انتها و دندانه هایی کوچک در اطراف نیش وجود دارد.
این اندام جنگالی شکل را چنگال یا کلیسه می گویند.
عنکبوت برای شکار، سم خود را از نوک کلیسه وارد بدن طعمه می کند. و بعدش از مرگ از همین چنگال ها مایعی را وارد بدنش می کند این مایع سبب می شود که محتویات داخل بدن موجود شکار شده به یک سوپ رقیق تبدیل شود.
آن وقت عنکبوت این سوپ رقیق را با کمک دهان و معده قوی خود می مکد بنابراین این چنگال ها برای عنکبوت ها نقش حیاتی دارند.
قسمت کناری بیرونی به وسیله ی دو اندام باریک و کشیده به نام پالپ محافظت می شوند.
پالپ ها هاعضو اصلی حس چشایی هستند و نقش زبان را ایفا می کنند. عنکبوت ها دو چشم دارند که در قسمت جلو سر قرار دارند. چشم ها در بعضی عنکبوت ها از جمله عنکبوت گرگی یا جهنده بسیار قوی است.
گروهی دیگر مانند عنکبوت های توربان حس بینایی ضعیف تری دارند. در بخش کناری سر سینه هشت پا قرار دارد.
پاها در حرکت شکار و دیگر فعالیت ها نقش دارند.
بدن
قسمت دوم شکم است شامل قلب معده اعضای تنفسی و غده های تولید تار
تارهای عنکبوت
تارهای عنکبوت در متال باغ ها و حتی روی گل ها دیده ایم عنکبوت ها به وسیله ی غده های موجود در انتهای شکم آن را تولید می کنند.
عنکبوت ها با این رشته ها تورهایی پر از پیچ و خم می سازند سپس روی تور با قطره های ریز و چسبنده ای که ترشح می کنند می پوشانند وقتی حشره ای به طور تصادفی روی تور بیفتد قطره های چسبناک مانع فرارش می شوند.
عنکبوت نیز لرزش های تور که ناشی از به دام افتادن حشره است حس کرده به طرف او می رود و ابتدا با سم او را از بین می برد و بعد از جسدش تغذیه می کند.
باید دانست البته همه ی عنکبوت تار نمی بافند عنکبوت ها تخم های خود را در کیسه هایی که از رشته های تاری ساخته اند قرار می دهند و آن را در شکافی در تنه درختان و یا دیوارها پنهان می کنند.
برخی نیز کیسه ی تخم را در حالی که هنوز به انتهای شکم وصل است به خود حمل می کنند. وقتی نوزاد ها از تخم خارج می شوند کیسه را پاره کرده از بیرون می آیند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
کرم ابریشم
اهمیت کرم ابریشم به جهت تولید ابریشم است که مایع ترشح شده از غده های دهان کرم است. این مایع به محض خروج از دهان منجمد می شود و چون به صورت پیوسته از منفذ خیلی باریکی خارج می شود، پس از انجماد به صورت الیاف باریک و ظریف ابریشم ظاهر می گردد.
در واقع ابریشم پیله ای است که کرم ابریشم جهت طی مراحل دگر دیسی دور خود تنیده است.
پروانه ها که تغییر یافته ی کرم های داخل پیله هستند قبل از خروج از آن به وسیله گرما یا بخار آب خفه می شوند تا نتوانند پیله را سوراخ کنند.
چون این کار باعث آسیب رسیدن به الیاف ابریشم می شوند. بعد از قرار دادن پیله ها در آب گرم به وسیله ی ماشین ریسندگی الیاف را ریسیده و باز می کنند. نخ ابریشمی به صورت کلاف به دست می آید. هر پیله در حدود 1000 متر نخ ابریشم می دهد.
غذای اصلی کرم های ابریشم برگ درخت توت سفید است. بنابراین شروع مرحله ی پرورش کرم و یا زندگی آن به طور طبیعی با وضعیت آب و هوایی و زمان جوانه زدن درخت توت تناسب دارد.

کرم های ابریشم به شدت گرسنه هستند و در مدت کوتاهی مقدار زیادی برگ توت تغذیه می کنند.
در پرورش کرم ابریشم برگ های درخت توت را خرد می کنند و به صورت یک نواخت در اختیار لاروهای بیرون آمده از تخم قرار می دهند.
اتاق پرورش کرم های جوان می بایست از نظر حرارت رطوبت و تهویه قابل کنترل می باشد.
به دلیل حساسیت کرم های جوان به عوامل بیمای زا و به منظور پیگیری از شیوع بیماری در مراحل پرورش آن ها می بایست بدنشان را هر روز یا یک روز در میان به خصوص پس از زمان پوست اندازی آن ها ضدعفونی کنند.
به تدریج که جثه و اندازه کرم ها بزرگ شد، آماده ی تنیدن پیله می شوند، و نشانه های آن با کم اشتهایی، تغییر رنگ لارو (شفاف شدن) کوتاه شدن قد، کندی حرکت ترشح تارهای ابریشمی بالا گرفتن سر و تکان دادن آن، ترشح زیاد ادرار و تغییر بافت مدفوع بروز می کند.
کرم های ابریشم قبل ا آن که برای تنیدن تار آماده شوند، 4 بار پوست اندازی کرده اند، بار اول در 6 روزگی، بار دوم در 12 روزگی، بار سوم در 18 روزگی و بار چهارم در بیس و شش روزگی.
دوره ی تنیدن پیله در شرایط محیطی مناسب 3 تا 4 روز به طول می انجامد. و در صورت وجود این شرایط حدود 8 روز پس از آغاز تنیدن پیله شفیره کامل شده و می تواند پیله را به منظور ابریشم کشی برداشت نمود، زیرا در غیر این صورت به زودی پروانه ی بالغ پیله را سوراخ کرده و از آن خارج می شود، و با این اتفاق تارها قطعه قطعه شده، و دیگر قابل استفاده نخواهد بود.
یکی از حشرات بسیار سودمند برای بشر، کرم ابریشم و صنعت نوغانداری است.
این صنعت در کشورمان به مرور جایگاه ویژه ای پیدا کرده است و استان های گلستان، گیلان، مازندران، خراسان، آذربایجان شرقی، اصفهان و فارس، کشاورزان در کنار زراعت به پرورش کرم ابریشم اشتغال یافته اند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
ستاره دریایی Astercidea
ساختمان بدن ستاره سانان آن ها از یک صفحه ی مرکزی با تعدادی بازو است که از آن سرچشمه می گیرد.
بیش از 1500 گونه ستاره دریایی شناسایی شده اند.
آن ها یا روی کف ماسه ای و گل و لای ته اقیانوس می خزند و یا روی صخره های دریایی زندگی می کنند و معمولاً به رنگ زرد مایل به خرمایی دیده می شوند. اما بعضی از آن ها را در رنگ هایی مثل قرمز، نارنجی، آبی، صورتی، سبز و ... وجود دارند و می توان دید! در عین حال در رنگ های ترکیبی نیز مشاهده شده اند.
این جانوران تقریباً در تمام نقاط کره زمین وجود دارند. اما بیش از همه در آب های ساحلی دریاها دیده می شوند.
بیش ترین حضور را در سواحل شمال شرقی اقیانوس آرام دارند. در اطراف جزیره ی ونکوور vancover در کانادا هفتاد گونه ستاره ی دریایی می توان یافت.
ستاره های دریایی دارای ساختمان بدن 5 ضلعی هستند و اکثر گونه های آن ها 5 بازو دارند اما گاهی دارای تعداد زیادتری بازو می باشند. مثلاً در ستاره های دریایی خورشیدی اروپایی در حدود 7 تا 14 بازو وجود دارد.
هم چنین در ستاره های دریایی که در سواحل غربی امریکا دیده می شود heliaster در حدود 40 بازو وجود دارد.
قطر بدن در ستاره های دریایی بین 12 تا 24 سانتی متر است اما هستند ستاره های دریایی که قطر بدنشان تنها 2 سانتی متر باشد.
فرق در ستاره های دریایی که در سواحل شمال غربی ایالات متحده دیده می شوند فاصله ی بین بازوها تا یک متر نیز می رسد.
تمام سطح زیرین صفحه ی مرکزی به همراه بازوها به نام سطح دهانی نامیده می شود و دهان ستاره در مرکز آن قرار گرفته است. از دهان یک شیار به داخل هر بازو امتداد پیدا می کند.
هر شیار حاوی دو یا چهار ردیف پاهای لوله ای است که جزو اندام حرکتی محسوب می شود.
حاشیه شیارها یا خارهای متحرکی محافظت می شود این خارها قادرند روی اشیاء را بپوشانند. سطح کلی بدن ستاره ی دریایی زبر است و بر آن خارها، برجستگی و ... قرار دارد.
نوعی ستاره دریایی به نام آکاناستر acanthuster وجود دارد که دارای خارهایی با طول 3 سانتی متر است. این جانور روی صخره ها زندگی می کند.
در بعضی از ستاره های دریایی نیز که خارها پهن و مسطح شده اند. بدن نسبتاً صاف است.
اسکلت بدن ستاره سانان از استخوان چه های ossicle مجزا از هم تشکیل شده است. این استخوان چه ها به شکل های صلیبی، میله ای یا صخره ای و از جنس آهک هستند.
استخوان چه ها شبکه ی مشبکی را به وجود می آورند که به وسیله ی بافت پیوندی به یکدیگر متصل است. و فضای بین آن ها بر حسب شکل استخوان چه متفاوت است. مثلاً در شکل صفحه ای استخوان چه طبیعتاً این فضا کم تر است.
مشبک بودن استخوان چه ها در ستاره های دریایی احتمالاً به دلیل کاهش در وزن بدن و افزایش توان جانور است. هر خار در ستاره ی دریایی امتداد استخوان چه های جانور است که به سطح خارج بر جستگی پیدا کرده است.
زمان تولید مثل ستاره های دریایی که در دریاهای با درجه حرارت معتدل زندگی می کنند فصل ها راست در طی تخم ریزی ستاره های دریایی ماده گاهی تا دو و نیم میلیون تخم می گذارد.
تعدادی ستاره ی دریایی که در دریاهای قطب شمال و جنوب وجود دارند که تخم های خود را پرورش می دهند. تخم های این جانوران معمولاً بسیار بزرگ بوده حاوی مقدار زیادی زرده است و طبیعتاً تعداد کم تری دارد.
تعدادی از ستاره سانان به طور طبیعی با تولید مثل غیر جنسی تکثیر پیدا می کنند.
سپس هر یک از دو قسمت صفحه ی مرکزی و بازوها را ترمیم می کند گاهی ممکن است علاوه بر بازوهای از دست رفته بازوهای اضافی نیز به وجود آید.
حتی یک نوع ستاره ی دریایی وجود دارد که قادر است بازوهای خویش را از محل چسبیدن به صفحه ی مرکزی قطع کند.
سپس این بازوی قطع شده از خود یک صفحه ی مرکزی و بازوهای جدید به وجود می آورد. این ستاره ها را در زیان محاوره ای ستاره ی دنباله دار می گویند .
ستاره های دریایی توانایی ترمیم بسیار زیاد است در بعضی گونه ها حتی اگر یک پنجم صفحه ی مرکزی به صورت چسبیده به یک بازو باقی بماند مجدداً یک ستاره ی دریایی کامل به وجود خواهد آمد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اسفنج ها
اسفنج از جانوران پریاخته پست هستند که در اغلب مواقع شبیه گیاهانند و قادر به حرکت نیستند.
اسفنج ها در گونه های مختلف با شکل های گوناگون یافت می شوند. مسطح، گرد، کوزه ای، منشعب و یا حتی غیر منظم دیده می شوند.
بسیاری از اسفنح ها خاکستری یا خرمایی رنگ می باشند. در حالی که اسفنج هایی نیز به رنگ های قرمز شفاف، زرد، آبی یا سیاه نیز دیده می شوند.
تمامی اسفنج ها آبزی هستند و اکثر گونه ها دریایی اند و تا عمق بیش از 7 کیلومتری اقیانوس دیده می شوند و به تخته سنگ ها صدف ها و یا سایر اشیای سخت می چسبند.
یک نوع اسفنج وجود دارد که در آب شیرین زندگی می کند.
اسفنج تجارتی حمام در واقع اسکلت قابل ارتجاع یک گونه اسفنج دریایی است. که تمام پروتوپلاسم آن که قبلا زنده بوده از بین رفته است.
اسفنج ها به طور کلی
اسفنج ها را اصطلاحا به نام پارازوآ Prazoa می نامند. که به زبان یونانی پارا به معنی در کناره بوده و مفهوم آن اینست که اسفنج ها در خط مستقیم تکامل بین جانوران تک سلولی و جانوران پر سلولی قرار نمی گیرند.
اسفنج ها فاقد اعضای حسی یا سلول های عصبی هستند. به جز مقدار کمی، قادر به حرکت یا انقباض بدن خود نمی باشند.
تولید مثل
اگر قسمت هایی از یک اسفنج در اثر زخمی شدن از بین برود در اثر ترمیم Regeneration جایگزین خواهد گردید.
بسیاری از گونه های اسفنج ها در اثر جوانه زدن تکثیر می یابند. جوانه ها یا در وقتی که رشد اسفنج افزایش می یابد از اسفنج مادر جدا می شوند و یا این که به صورت چسبیده به کلنی اسفنجی باقی مانده و در این صورت برای افزایش قسمت های موجود کلنی اسفنج به کار می روند.
اسفنج های آب شیرین و برخی دیگر از انواع آن ها از طریق ژمول Gemmule یا جوانه های داخلی افزایش می یابند.
ژمول ها قادرند که گونه اسفنج را در مقابله با سرما خشکی و یا سایر شرایط نا مساعد محیط محافظت نمایند.
در تولید مثل به طریقه جنسی بعضی از اسفنج ها هم تخمک و هم اسپرم را تولید می نمایند. در حالی که در بعضی از اسفنج ها جنسیت مجزا می باشد.
رابطه ی اسفنج ها با سایر موجودات
جانوران کمی وجود دارند که به اسفنج حمله می کنند یا از آن ها تغذیه می نمایند. که احتمالا این موضوع به خاطر وجود اسپیکول در اسفنج ها و یا به خاطر ترشحات نامطبوع آن ها باشد.
اما بسیاری از بند پایان، کرم ها، نرم تنان برخی از ماهی ها در حفره های موجود در بدن اسفنج ها به سر می برند. برخی از نرم تنان دریایی نیز از اسفنج ها تغذیه می کنند.
هم چنین خرچنگ ها تکه ای از اسفنج زنده را به صدف خود می چسبانند. نوعی اسفنج نیز معمولا بر روی صدف حلزونی که به عنوان پناهگاه خرچنگ زاید مورد استفاده قرار می گیرد رشد می کند. که در نهایت باعث جذب صدف گردیده، به طوری که خرچنگ به زودی در داخل اسفنج زندگی خواهد کرد.

از زمان های قدیم انسان همیشه اسکلت رشته ای اسفنج حمام Spongia را مورد استفاده خود قرار داده است.
غواصان و صیادان آب های مدیترانه و خلیج مکزیک سالیانه بیش از یک میلیون کیلو اسفنج صید می نمودند.
بدین ترتیب که اسفنج ها بر روی آب آورده می شوند قسمت های پروتوپلاسمی آن را می گذاردند تا بگندد. آن گاه بخش شیشه ای تمیز گردیده و خشک می شد.
و سپس آن را قطعه قطعه کرده و به فروش می رساندند. امروزه با وجود اسفنج مصنوعی صید طبیعی چندان رونق ندارد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
نرم تنان








صدف این جانوران یک تکه بوده و معمولا مخروطی شکل است و توده ی احشایی را احاطه کرده است. سرو پای عضلانی معمولا تقارن دو طرفه دارند ولی به علت پیچ خوردگی توده ی احشایی این تقارن در آن قابل مشاهده نیست.
شکم پایان از طریق جبه (جلد) و یا حفره ی جبه که در واقع نقش شش را ایفا می کند، تنفس می کنند.
 حلزون باغی را همه ی ما می شناسیم این جانور، موجود فعالی است در سرش دو جفت شاخک دارد یک جفت آن چشمی و دیگری حسی است.
حلزون باغی را همه ی ما می شناسیم این جانور، موجود فعالی است در سرش دو جفت شاخک دارد یک جفت آن چشمی و دیگری حسی است.
دهان که چندان هم مشخص نیست یک منفذ شکاف مانند می باشد، درست در زیر قسمت پایی سری قرار گرفته است.
پای عضلانی که دارای تقارن دو طرفی است مرز مشخصی با سر ندارد. توده ی احشایی جانور مرکب از امعاء و احشاء پیچ خورده و توسط یک صدف یک تکه ی مارپیچ احاطه شده است.
جبه ی پوشاننده ی توده ی احشایی، در حاشیه ی پایینی اش، کمی ضخیم تر است.
جز در یک نقطه منفذ ریه که در سمت راست بدن واقع است،
و رد آن جبه با دیواره ی بدن اتصال ندارد، و حفره ی جبه با دیواره ی عروقی و مملو از هوا، از فاصله گرفتن جبه از دیواره ی بدن ایجاد شده است این حفره نقش ریه یا شش را برای جانور بازی می کند.
پوسته در بسیاری از شکم پایان ساختاری پیچیده دارد. ظاهری به شکل مخروط خالی دارد و در قسمت مرکزی دارای یک محور مرکزی تو خالی به نام ستونک یا Columella است. که اغلب از راه یک منفذ تحتانی به بیرون راه دارد.
در موقع استراحت و به هنگام خطر قسمت پایی سری که توسط یک عضله به نام عضله ی ستونکی به ستونک یا کلوملا اتصال دارد. به داخل صدف کشیده می شود.
لبه ی آزاد جبه پر رنگ و دارای غدد مخاطی (موکوسی) و غدد آهکی است.
پوسته ای از لایه های متعددی ساخته شده که به جز داخلی ترین آن ها، بقیه توسط یقه ی جبه ساخته می شوند. این لایه ها دارای اسامی و جنس متفاوتند.
کانال گوارشی
کانال گوارشی یا لوله گوارش از دهان شروع می شود که به شکل شیاری است در سمت زیری و انتهایی جلوی بدن جانور واقع است.
بعد از دهان مری قرار دارد که باریک است و به یک چینه دان وصل می شود. دو غده ی بزاقی به موازات چینه دان قرار دارند که ترشحات خود را به قسمت جلویی مری می ریزند. این ترشحات حاوی آنزیم های متعدد است و می تواند سلولز را هضم کند.
بعد از چینه دان و بعد معده قرار دارد و سپس روده ی پیچ خورده که به مخرج منتهی می شود.
سیستم گردش خون
شکم پایان در سیر تکاملی خود یک دهلیز را از دست داده اند و قلبشان یک بطن و یک دهلیز ندارد. رنگیزه ی تنفسی هموسیامین نام دارد و خون آبی رنگ است.
سیستم دفعی
شکم پایان تنها یک کلیه دارند ماده دفعی نیز به تناسب زندگی در خشکی اسید اوریک و کمی آب است.
تولید مثل
 حلزون باغی موجود نر – ماده است و یا بعضا تک جنس یا هر مافرودیت بوده ولی یک غده ی نر – ماده دارد که قادر است یاخته جنسی نر و ماده ایجاد کند.
حلزون باغی موجود نر – ماده است و یا بعضا تک جنس یا هر مافرودیت بوده ولی یک غده ی نر – ماده دارد که قادر است یاخته جنسی نر و ماده ایجاد کند.
این موجود قادر است از اسپرم خود برای بارور کردن تخمک هایش استفاده کند. (و یا بعضا از اسپرم فرد هم گونه دیگر)
پس از بارور شدن تخمک ها جانور اقدام به تخم گذاری می کند تخم ها اغلب در درون یک غلاف در سوراخ ها یا در زمین گذاشته می شوند و بعد از چند هفته حلزون های جوان سر از تخم بیرون می آورند.
سیستم عصبی
عقده ها (گره های عصبی) چنان اند که تشخیص انفرادی آن ها مشکل است. همه ی بدن دارای حس لامسه و دیگر حس هاست. عمده ترین اعضای حسی به دو شاخک حسی و مخصوص حس شیمیایی، دو شاخک چشمی و در بر دارنده ی دو چشم ساده که برای دید محدود مناسب است و دو عضو مربوط به حس تعادل یا اتو سیست ها واقع در زیر غدد پایی محدود می شوند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
زمین لرزه چیست ؟

ارتعاشات شدید ایجاد شده که همان امواج زمین لرزه هستند از شکاف اولیه که کانون زلزله نام دارد، پراکنده می شوند. این ارتعاشات هم چون امواج ریزی که در برخورد سنگ بر روی برکه ایجاد می شوند، در جهات مختلف و در مسیری طولانی از اطراف کانون منتشر شده و در مسیر خود موجب لرزش زمین می گردند. امواجی که به کانون نزدیک هستند بسیار بزرگ بوده که این امر قدرت تخریب بیش تری به آن ها می دهد.
زمین لرزه چگونه و در کجا رخ می دهد؟
اگر نقشه ی زمین لرزه در سراسر جهان را بررسی کنیم، این نکته برایمان آشکار می شود که :
به عنوان نمونه تعداد زیادی از زمین لرزه ها در محدوده حاشیه اقیانوس آرام و یا در وسط اقیانوس اطلس گزارش شده اند. این کمربندها سر نخ های مهمی جهت بسط نظریه صفحات تکتونیک plate tectonic ارائه می کنند.
خارجی ترین پوسته زمین، که همان لیتوسفر نام دارد، از بخش های سخت بسیاری تشکیل شده است که به آن ها سطوح تکتونیک گفته می شود.
این سطوح همواره توسط نیروهایی که در عمق زمین وجود دارند حرکت داده می شوند. میزان این جابه جایی به اندازه چند سانتی متر در سال (تقریبا برابر با رشد ناخن های دست ما) هستند.
در زیر سطوح لیتوسفر، استنوسفر زمین قرار دارد که در بازه زمانی طولانی رفتاری هم چون سیال از خود نشان می دهد و به این ترتیب به جابه جایی پوسته های زمین کمک کرده و آن ها را هم چون نوار نقاله ای عظیم هدایت می کند.
امواج زلزله ای:
با جابه جایی ناگهانی دریک شکاف دو نوع متفاوت از امواج زلزله ای تولید می شوند : امواج P (امواج اولیه ) و امواج S (امواج ثانویه ). البته نوع سومی از امواج زلزله نیز از بر همکنش امواج P و S با سطح داخلی لایه های زمین تولید می شود. سرعت امواج به نوع موج و ویژگی های محیط انتشار بستگی دارد هرچه تراکم سنگ های محیط بیشتر باشد امواج سریعتر حرکت می کنند. در پوسته زمین امواج P با سرعتی درحدود 6 تا 7 کیلومتر در ثانیه حرکت می کنند در حالی که سرعت امواج S در حدود 5/3 تا 4 کیلومتر در ثانیه می باشد.
جابه جایی امواج P سریع تر است . شکل آن ها مثل امواج صوت در هوا موج طولی بوده و دارای انقباض و انبساط پی در پی و موازی با انتشار می باشند.
امواج S آهسته تر از امواج P بوده و امواجی عرضی هستند به این معنا که حرکت ذرات عمود بر جهت انتشار صورت می گیرد. امواج S به دلیل عرضی بودنشان امکان عبور از درون هوا و یا مایعات را ندارند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پایداری جو

تشکیل ابر نتیجه صعود هوا و سرد شدن آن به صورت بی دررو است. وقتی بسته هوایی صعود می کند، فشار هوای اطراف آن کاهش می یافته و باعث انبساط این بسته هوا می شود.
از آن جا که انرژی موردنیاز برای انبساط از هوای داخل بسته تامین می شود، دمای هوای این ناحیه کاهش می یابد. با توجه به این که هوا یک هادی بسیار ضعیف برای گرماست، فرض بر این است که هیچ گونه تبادل انرژی بین این بسته هوا و نواحی دیگر صورت نمی گیرد.
فرآیندی که در آن هیچ گونه گرمایی به سیستم داخل و یا از آن خارج نشود "بی دررو" می نامند.
پایداری جو:
ارزیابی پایداری جو مبتنی بر دانشی است که از محیط در اختیار داریم. آهنگ کاهش بی درروی هوای خشک (DALR) و آهنگ کاهش دمای بی درروی اشباع (SALR) ارزش زیادی در ایجاد توانایی پیش بینی چگونگی تشکیل ابرها و شرایط جویی مربوط دارند.
1. جو ناپایدار:
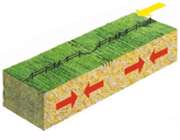
هرگاه یک بسته هوای اشباع و یا غیراشباع که به صورت بی دررو بالا رفته و سرد می شود، تمایل به صعود داشته باشد، جو را مطلقا ناپایدار می نامند. در شکل یک بسته هوا که در سطح AA دمایی بیش تر از دمای محیط دارد دارای چگالی کم تری است و در نتیجه سبک تر بوده و بالا می رود.
از طرف دیگر برای یک بسته هوایی که نزول می کند به صورت بی دررو گرم شده و دمای آن در هر سطحی کم تر از دمای هوای محیط بوده و در نتیجه به نزول خود ادامه می دهد. در یک جو مطلقا ناپایدارELR>DALR>SALR. (ELR: آهنگ دما به صورت بی دررو)
توجه:
2. جو پایدار:
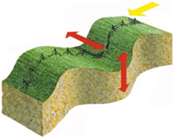
هرگاه یک بسته هوای اشباع که در حال صعود به صورت بی دررو است، سرد می شود و تمایل به بازگشت به سطح اولیه خود را داشته باشد جو را پایدار می نامند. در شکل زیر یک بسته هوا در سطح BB دمایی کم تر از دمای محیط دارد ولی چون دارای چگالی بیش تری است سنگین تر از هوای اطراف خود بوده، تمایل به بازگشت به سطح اولیه خود را دارد.
از طرف دیگر برای یک بسته هوایی که در حال نزول است و به صورت بی دررو گرم می شود، چون گرم تر از هوای اطراف است تمایل به بازگشت به سطح اولیه خود را خواهد داشت. بنابراین در جو مطلقا پایدار باید نامساوی زیر برقرار باشد: DALR>SALR>ELR.
3. ناپایداری مشروط:
هرگاه یک بسته هوای غیر اشباع که در حال صعود بوده و به صورت بی دررو سرد شود، در سطحی که دمای آن پایین تر از دمای محیط است قرار بگیرد، جو را به صورت مشروط ناپایدار می نامند. در شکل زیر این شرایط در سطح CC برقرار است و از آنجا که بسته هوا چگالی تر از هوای اطراف آن است، تمایل به بازگشت به سطح اولیه خود را دارد و در هر حال یک بسته هوای اشباع در این سطح که در حال صعود به صورت بی دررو سرد شده است، دمایی بیشتر از دمای هوای اطراف را داشته و به صعود خود ادامه خواهد داد. در یک جو مشروط ناپایدا ر باید نامساوی زیر برقرار باشد: DALR>ELR>SALR.
4. پایداری خنثی:
هرگاه ELR با DALR و یا ELR با SALR مساوی باشد، جو در حالت خنثی قرار دارد. در این حالت بسته هوا که صعود (نزول) نموده و به صورت بی دررو سرد (گرم) شده، تمایل به باقی ماندن در وضعیت جدید خود را دارد.
از آن جا که DALR ثابت است، اگر برای SALR نیز مقداری معین در نظر بگیریم، آن گاه نقش ELR در تعیین وضعیت پایداری جو در یک زمان مورد نظر اساسی خواهد بود.
با ثبت دمای هوا در طی یک صعود کاوشگر ممکن است قادر به تعیین ELR در لایه های مختلف وردسپهر بوده، بنابراین بتوانیم پایداری در این لایه ها را ارزیابی کنیم.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
نکات جالبی درباره ی گازها

دیدکلی
این گازها از مخلوط شدن گازهای گوناگون مانند CO2 ، He ، H2S ، N2 با هیدروکربن ها تشکیل میشوند. هیدروکربن ها معمولا ازنوع متان و دیگر پارافینهای ردیف پایین هستند. فشار و دما، ترکیبات گاز در فازهای مختلف را معین میسازد. درنتیجه کاهش فشار ، اکثر هیدروکربن های ردیف بالا تغییرحالت میدهند، یعنی گازهای مرطوب درست میشوند. درصورتی که تمام گازهای خشک تقریبا از متان درست میشوند.
گازهای مرطوب شامل متان و مقدار قابل توجهی از آلکانها با تعداد کربن بالا هستند.

هیدروکربن های گازی متعلق به سری نفت های پارافینی
گازهای خشک (Dry Gases)
این گازها حاوی مقدار زیادی متان میباشند (64 الی 96 درصد) و این گازها به سختی تبدیل به مایع میشوند. در کانسارهای زغال سنگ و مناطق مردابی نیز گازهای خشک به وفور یافت میشوند که قسمت عمده آن ها از متان به وجود آمده است. گاز متان در حرارت و فشار موجود در منابع زیرزمینی قابل تراکم نیست. بنابراین همیشه به صورت گاز در کانسارها وجود دارد و فقط در نتیجه فشارهای زیاد میتواند در نفت حل شود.
گازهای مرطوب (Wet Gases)
این گازها تقریبا به سهولت میتوانند به مایع تبدیل شوند و دارای مقدار زیادی از پارافینهای ردیف بالا مانند اتان ، پروپان ، هگزان و هپتان میباشند. این گازها را میتوان تحت فشار و حرارت زیاد به مایع تبدیل کرد. لذا نسبت به شرایطی که در کانسار حاکم است، این گازها به شکل فاز مایع یا فاز بخار در آن جا وجود دارند.

لایههای مخازن نفت و گاز
گازهای طبیعی در کانسارهای نفت
بنابر آنچه گذشت، گازهای طبیعی ممکن است همراه با نفت و یا به صورت مجزا تشکیل کانسار دهند که هر دو نوع آن ، از نظر اقتصادی خیلی با ارزش میباشد. در کانسارهای نفت، امکان دارد که گازهای طبیعی به حالت های مختلف دیده شوند. غالبا این گازها قسمت فوقانی منابع را اشغال کرده، چون وزن مخصوص کمتری دارند، در نتیجه یا روی نفت و یا روی آب قرار دارند. ولی بعضی اوقات در کانسارهای نفت حاوی گاز ، درصد قابل ملاحظهای از گازها به صورت محلول قرار میگیرد که نسبت آن وابسته به اختصاصات فیزیکی نفت و گاز و همچنین حرارت و فشار منبع یا مخزن است.
گاهی ممکن است دریک مخزن ، درصد قابل ملاحظهای از گازهای طبیعی محلول در آب باشند. در اعماق بیش از دو هزار متری نیز ، تحت شرایط فشار و حرارت زیاد ، گازهای مخلوط در نفت از نظر فیزیکی غیر قابل تشخیص میباشند.

گازهای ترش و شیرین
گازهایی که دارای CO2 و گوگرد هستند، به نام گازهای ترش و گازهای دارای گوگرد کمتر را گازهای شیرین گویند.
کانسارهای گازهای طبیعی
گازهای طبیعی زیرزمینی یا به تنهایی و یا به همراه نفت تشکیل کانسار میدهند. درصورت همراه بودن با نفت گازها در داخل نفت حل میشوند و درصورت رسیدن به درجه اشباع ، تجزیه شده ، در قسمتهای بالای افقهای نفتی به شکل گنبدهای گازی قرار میگیرند.
مهار گازهای طبیعی
اگرچه هنگام استخراج نفت ، سعی میشود برای نگهداری انرژی کانسار از استخراج آن جلوگیری شود، باز این گاز حل شده در نفت در هنگام استخراج به همراه آن خارج میشوند. درسال های گذشته این گازها را آتش میزدند. ولی امروزه از آن ها به عنوان مواد خام شیمیایی و ماده سوختنی با ارزش استفاده میکنند.

ترکیب گازهای طبیعی
دربعضی جاها ، گازهای زیرزمینی دارای نیتروژن بیشتر (کانزاس) یا CO2 بیشتر (مجارستان ، کلرادو) درخود هستند. بخشی از CO2 ، از محصولات تشکیلات نفتی و بخشی نیز با منشاء آتشفشانی بوجود میآید. مقدار جزئی هیدروژن نیز در اکثر مواقع پیدا شده است. گازهای ازتدار میتوانند تا 2.5 درصد حجمی هلیوم داشته باشند (مانند ایالات متحده امریکا). از شکسته شدن عناصر رادیواکتیو درون سنگ های ساحلی هلیوم به وجود میآید. گازهای دارای سنگ مخزن کربناته ، دارای مقدار زیادی H2S هستند.
رسیدن گازهای طبیعی به سطح زمین
بیرون آمدن گازهای طبیعی زیرزمینی به سطح زمین ، همانند بروز نفت به سطح زمین ، از پدیدههای مهم بوده ، توسط میزان بیرون آمدن گازطبیعی میتوان در مورد پتانسیل کانسارهای هیدروکربنی ، اطلاعات با ارزش و مهمی بدست آورد. ولی تشخیص و تفکیک این گازها خیلی ساده نیست تا بدانیم آیا این گاز مربوط به گاز مردابی یا گاز زغال سنگ و یا گاز مربوط به نفت است. از وجود هیدروکربنهای ردیف بالا ، میتوان گفت که این گاز از نوع زیرزمینی است.
گازهای موجود در کانسارهای زغال سنگ
این نوع گازها تا 6 درصد حاوی هیدروکربن های ردیف بالا هستند. گازهایی که منشاء آن ها مربوط به زغال سنگ است، خیلی کمیاب هستند (مانند گازهای موجود در کانسارهای زغال سنگ هلند) و علت آن را چنین توجیه میکنند که این نوع گازهای حاصل در مرحله زغال شدگی برای خودشان سنگ مخزن خوبی پیدا نمیکنند تا جمع شوند.

تفکیک گازهای طبیعی از نفت
گازی که همراه نفت است، باید از آن جدا شود تا نفت خالص به دست آید. اگر نفت و گازی که باهم از چاه خارج میگردند، پیش از آن که از هم جدا شوند، مستقیما به مخازن نفت هدایت گردند، گاز چون سبک و فرار است، مقداری از آن ، از منافذ فوقانی مخزن به هوا میرود و در ضمن ، مقداری از اجزای سبک و گرانبهای نفت را هم با خود خارج میکند. از این رو ، نفت را پس از خروج از چاه و پیش از آنکه به مخزن بفرستیم، به درون دستگاه تفکیک که نفت و گاز را از هم جدا میسازد، هدایت میکنیم.
دستگاه تفکیک نفت و گاز
این دستگاه به شکل یک استوانه قائم است که در آن ، ذرات گاز از هم باز و به اصطلاح منبسط میگردد و در این ضمن ، از سرعت آن نیز کاسته میشود. وقتی فشار و سرعت گاز ، خیلی کم شد، مقدار زیادی از آن ، از نفت جدا میگردد. آنگاه آن را توسط لوله به درون ظرفی هدایت کرده ، از آن استفاده میکنند.

گازهای طبیعی تفکیک شده
گازی که از دستگاه جدا کننده خارج میگردد، غالبا از نوع گاز تر است و مقدار زیادی بنزین سبک همراه دارد. این بنزین طبیعی ، بسیار مفید و قیمتی است. از این رو ، نباید آن را به هدر داد. در اوایل پیدایش صنعت نفت ، از این ماده گرانبها استفادهای به عمل نمیآمد و آن را همراه با سایر اجزای گاز به هدر میدادند. اما رفته رفته که به اهمیت و فواید این گاز پی بردند، سعی شد که بنزین طبیعی آن را استخراج نموده ، از بقیه اجزای آن نیز به انواع گوناگون استفاده شود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
مه

مه به دلایلی متفاوت شکل می گیرد که نحوه تشکیل و مشخصات انواع آن به شرح زیر است:
مه فرارفتی:
این مه در صورتی شکل می گیرد که یک توده هوای گرم با رطوبت نسبتا زیاد به طور افقی (فراررفتی) روی سطحی خنکتر حر کت کند که دمای این سطح، زیر نقطه شبنم توده هوای گرم باشد.
هنگامی که بر اثر هدایت توام با آشفتگی، هوا تا زیر نقطه شبنم خنک شود، بخار آب متراکم شده، قطره های آب غبار مه را ایجاد می کند. این نوع مه که تحت شرایطی متنوع از سرعت باد شکل گرفته و دوام می یابد، درجه تلاطم بیتشرین ارتفاع هوای سرد را تعیین می کند. این ارتفاع با ازدیاد سرعت باد افزایش می یابد بنابراین گرادیان(اختلاف) دمایی بین هوا و سطح به همراه میزان تلاطم، احتمال تشکیل مه فرارفتی را معین می کند.
سرعت های کم باد شرایط بهتری را مهیا می سازد، البته با گرادیان دمایی شدیدتر مه فرارفتی می تواند در بادهای شدید نیز ایجاد شود.

در هر صورت در سرعت های زیاد باد به همراه گرادیان های دمایی کوچکتر احتمال تشکیل ابر پوشن با ارتفاع کم بیشتر است، به این دلیل که آهنگ سرد شدن هوا توسط سطح کوچکتر بوده و تا ارتفاع زیادتری گسترش می یابد. در این شرایط به طور معمول جو پایدار است زیرا خنک شدن هوا باعث کاهش ELR (آهنگ کاهش دما به صورت بی دررو) می شود.
مه فرارفتی دریایی که مه دریایی نامیده می شود، در مواقع خاصی از سال رخ می دهد. در عرض های جغرافیایی شمالی، در سواحل نیوفاندلند و در محدوده شمالی اقیانوس آرام این نوع مه به خصوص در ماه جولای از شدت بیشتری برخوردار است. این مه هنگامی به وجود می آید که هوای گرم که از جنوب غربی و جنوب می ورزد به ترتیب از روی آب های سرد لابرادور و اویوشیو و یا آلوتیان عبور کند. مه دریایی روی این مناطق می تواند تا مدت ها باقی بماند و افزایش سرعت و یا تغییر جهت باد تنها باعث پخش شدن بیشتر آن می شود. همچنین در طول تابستان و در عرض های پایین تر در محدوده جریان های سرد کالیفرنیا، جزایر قناری و پرو مه دریایی رخ می دهد.

باید یادآور شد که تنها جریان های سرد باعث ایجاد مه دریایی نمی شوند بلکه در شرایط مناسبی از باد، هوا و دمای سطح آب نیز مه دریایی می تواند تشکیل شود. به عنوان مثال در دریای شمال در فصل تابستان و هنگامی که باد از سمت شمال شرقی، شرق و گاهی جنوب می وزد، پس از عبور روی اروپا به آب های سرد رسیده و مه دریایی را تشکیل می دهد. این مه در ساحل شرقی جزایر بریتانیا با نام Sea fret شناخته می شود.
مه فرارفتی دریایی روی خشکی ممکن است زمانی که هوا روی سطوح سرد جریان می یابد، تشکیل شود. تشکیل این مه را در نواحی سردسیر کشور هنگامی که تحت وزش بادهای گرم جنوب قرار می گیرند، می توان مشاهده کرد.
مه دریایی برای دریانوران و مشاغل مرتبط با دریا یک تهدید جدی به حساب آمده و پیش بینی آن ضروی است. از آن جایی که دمای آب و نقطه شبنم هوا دو پارامتر اساسی برای تشکیل این مه می باشند، با اندازه گیری مدام آن ها می توان زمان تشکیل این مه را پیش بینی کرد.
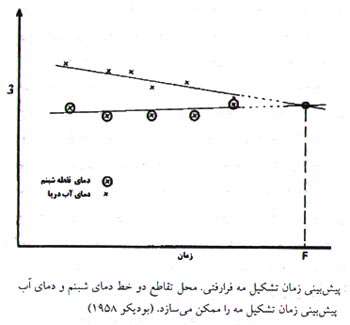
مه دود دریایی:
مه دود دریایی زمانی تشکیل می شوند که سطح دریا ظاهری بخار آلود و دودآلود داشته باشد. این نوع مه در ناحیه هایی محدود و تا ارتفاعی محدود شکل می گیرد. این نوع مه زمانی تشکیل می شود که هوای سرد روی آب گرمتر که اختلاف دمایی در حدود 10 درجه دارد بوزد؛ بدین صورت که هوای بالای سطح با تبخیر آب اشباع می شود. سپس این هوا صعود کرده و با هوای سرد بالاتر می آمیزد. در این شرایط که مخلوط به حالت اّبّر اشباع تراکم رسیده و ذره های آب ایجاد شده تشکیل مه دود دریایی را می دهد. از آن جایی که هوا توسط سطح زیرین آن گرم می شود، ELR محیط از گونه ناپایدار می باشد.
سرعت باد می تواند از کم تا حد توفان تغییر کند. این مه برای اختلاف های دمای کمتر بین آب و هوا در سرعت های زیادتری ایجاد می شود چرا که این امر باعث تامین هوای سرد در بالای سطح آب می شود. در ساحل شرقی امریکای شمالی و قاره آسیا در طول زمستان هنگامی که هوای سرد پس از عبور از قاره ها بر روی رودخانه ها و آب های ساحلی می وزد، مه دود دریایی تشکیل می شود.

مه تابشی:
این نوع مه روی خشکی شکل می گیرد. آسمان صاف، رطوبت نسبی بالا، هوای نسبتا آرام و مدت زمان نسبتا طولانی برای سرد شدن هوای از جمله شرایطی است که باعث شکل گیری این نوع مه می شود.
در طول شب آسمان صاف باعث تابش قوی زمین در طول موج بلند می شود؛ این جریان باعث افت سریع دمای سطح شده، در نتیجه باعث سرد شدن هوای بالای آن از طریق هدایت و تلاطم می شود. با سرد شدن هوا تا زیر نقطه شبنم، تراکمی صورت نگرفته و در نتیجه مه تابشی شکل می گیرد. از آن جاکه مدت سرد شدن نقشی اساسی در تشکیل این نوع مه دارد این اتفاق اغلب در پاییز و زمستان و در عرض های متوسط و بالا و همین طور در مناطق کوهستانی رخ می دهد. سرد شدن هوا توسط سطح باعث کاهش ELR محیط و در نتیجه پایداری جو می شود. ایجاد وارونگی در سطح زمین نیز می تواند حاصل فرآیند فوق باشد.
از آنجایی که اختلاف دمای آب و هوا نمی تواند زیاد شود، تشکیل این نوع مه روی دریا غیرممکن است ولی دیده شده که این نوع مه به صورت فرارفتی وارد آب های ساحلی می شود و پس از گرفتن گرما از آب، ذرات آب آن تبخیر و مه ناپدید خواهد شد. در محدوده مدارگان این نوع مه به ندرت در سطح دریا مشاهده می شود ولی در اوایل بهار و روی رودخانه ها امکان تشکیل آن وجود دارد.
مه جبهه ای:
این نوع مه به همراه جبهه های هوای سرد و گرم و تحت شرایطی خاص شکل می گیرد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
آتشفشان
آتشفشان یک ساختمان زمین شناسی است که به وسیله آن مواد آتشفشانی ( به صورت مذاب ، گاز ، قطعات جامد یا هر سه) از درون زمین به سطح آن راه می یابند. انباشتگی این مواد در محل خروج، برجستگی هایی به نام کوه آتشفشان ایجاد می نماید.
آتشفشان یکی از پدیده های طبیعی و دائمی زمین شناسی است که در طول تاریخ زمین شناسی نسبتا بدون تغییر باقی مانده و در ایجاد، تحول و تکامل پوسته و گوشته زمین نقش اساسی داشته و دارد.
مواد مذاب توسط نیروی ارشمیدس یا فشار گازها و به دلیل سبكتر بودن ماگما از سنگ های اطراف خود به بالا رانده میشود و در نهایت در نواحی از پوسته كه ضعیف میباشد پوسته را شكسته و ماده مذاب به سطح زمین میرسد.

مواد مذابی كه در زیرزمین قرار دارند و از طریق دودكش یا لوله آتشفشانی به طرف بالا حركت مینمایند اصطلاحاً ماگما نامیده میشوند. بعد از اینكه این ماگما از آتشفشان فوران نموده با آن لاوا (گدازه) گفته میشود.
گدازه هنگامی كه از دودكش به خارج حركت مینماید ماده گداخته سرخ و متخلخلی میباشد اما در اثر سرد و اكسید شدن به رنگ قرمز تیره، خاكستری و یا رنگ های دیگر تغییر مینماید. گدازههای خیلی داغ، دارای گاز فراوان همچنین حاوی آهن و منیزیم به صورت سیال بوده و جریانی نظیر قیر داغ دارند. در صورتی كه گدازههای سردتر، با گاز كم و درصد بالای سیلیس و سدیم و پتاسیم جریان آرامی نظیر حركت عسل غلیظ روی شیب دارند.
 |
نمایش نحوه حرکت گدازه
ماده مذاب موجود در زیرزمین كه در حال صعود به طرف قسمت های بالای پوسته زمین میباشد حاوی بلورها، قطعات سنگ های دربرگیرنده گازهای محلول میباشد و این ماده مذاب عمدتاً حاوی اكسیژن، سیلیس، آلومینیوم، آهن، منیزیم، كلسیم، سدیم، پتاسیم، تیتانیم و منگنز میباشد. البته ماگماها ممكن است دارای عناصر دیگر به صورت جزئی باشند.
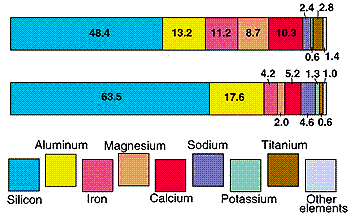 |
عناصر تشکیل دهنده گدازه در آتشفشان هاوایی
با سرد شدن به آرامی ماگما، بلورهای كانی های مختلف تشكیل شده و در نهایت كل ماگما به صورت جامد در آمده و سنگ های آذرین درونی و یا سنگ های ماگماتیك را ایجاد مینماید. پس از بلوری شدن نهایی و سنگی شدن ممكن است این تودهها تحت تأثیر عواملی نظیر فرسایش پس از هزاران و میلیونها سال در سطح زمین نمایان شود و بدینترتیب تودههای بزرگ از سنگ های آذرین درونی ظاهر میشوند. مثلاً گرانیت الوند همدان و یا گرانیت علمكوه از مثال های بارز در این رابطه میباشد.
ماگما دارای گازهای حل شده میباشد و با بالا آمدن ماگما به سطح زمین چون فشار طبقات بالایی كاهش مییابد این گاز آزاد شده و در نهایت اگر فشار گاز كافی باشد به آتشفشان حالت انفجاری میدهد. هرگاه گدازه به صورت سیال باشد و دارای گرانروی پایین باشد، گازهای موجود درآن به راحتی آزاد میشوند و آتشفشان به صورت آرام با خروج گدازه سیال به فعالیت خود ادامه دهد. ولی در صورتی كه گدازه ضخیم بوده و دارای گرانروی بالا باشد خروج گاز از ماگما به سختی انجام میشود و تراكم گاز در گدازه منجر به انفجار شده و آتشفشانهای انفجاری را ایجاد مینماید.
 |
نمایشی از نحوه خروج گاز آتشفشانی
گازهای موجود در گدازه را میتوان با گاز موجود در یك شیشه نوشابه مقایسه نمود. هنگامی كه انگشتمان را روی درب شیشه گذاشته و آن را به شدت تكان می دهیم گاز جدا شده از نوشابه به صورت حبابهایی ایجاد میشود و هر گاه انگشتمان را به صورت ناگهانی برداریم محتویات داخل نوشابه به بیرون فوران خواهد نمود. گازهای داخل ماگما نیز چنین رفتاری را از خود نشان میدهند.
جدایش شدید گازها از گدازه ممكن است تولید سنگی بنام پومیس را نماید. این سنگ به علت وجود حبابهای گاز در آن بسیار سبك بوده و بر روی آب شناور میباشد.
در بسیاری از آتشفشان های انفجاری شدت انفجار آنقدر زیاد بوده كه مقداری از مواد تشكیل دهنده آتشفشان به هوا پرتاب شده و بمبها و خاكسترهایآتشفشانی و گردوغبار آتشفشان ها را تشكیل دهند.
 |
سنگ پومیس که در اثر خروج گاز متخلخل شده
از نظر زمینشناسی 4 دسته آتشفشان وجود دارد:
1. مخروط خاكستر
2. مسطح
3. مركب
4. گنبد گدازه
1. مخروط خاكستر : از سادهترین نوع آتشفشانها است كه بر اثر منجمدشدن گدازههای بیرون ریخته از آتشفشان تشكیل شده است.
2. مسطح : از گدازه سیاه تشكیل شده و از تراكم متناوب مواد گدازه بوجود میآید.
3. مركب : این آتشفشان مجموعهای است از گدازه سیاه و خاكستر و ارتفاع آن تا هشت هزار پا نیز میرسد (مانند كوه فوجی یاما در ژاپن)
4. گنبد گدازه : گدازه بسیار ضخیم تشكیل شده و بجای جاری شدن در بالای آتشفشان انباشته میشود.
علیرغم خطارت و زیانهایی كه از ناحیه آتشفشانهای جهان متوجه انسان و محیط زیست او میگردد جمعیت زیادی در این مناطق سكونت دارند. وجود خاكهای حاصلخیز، چشمههای آب گرم، معادن غنی و ارزشمند، ذخایر گوگرد عوامل این مسئله هستند.
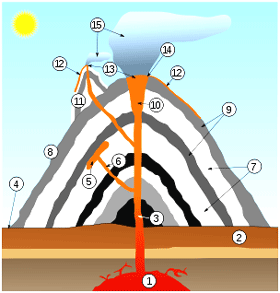 |
آتشفشان:
1.حجره بزرگ تفتالی
2. سنگبستر
3. مجرا
4. پایه
5. آذرینلایه
6. مجرای فرعی
7. لایههای خاکستر فورانشده
8. گُرده
9. لایههای گدازه
10. گلو
11. مخروط انگلی
12. جریان گدازهای
13. دودکش
14. دهانه
15. ابر خاکستر
بزرگترین آتشفشان کرهء زمین بزرگترین آتشفشان کره زمین مونالوآ نام دارد که بخشی از جزایر هاوایی را تشکیل میدهد. محیط قاعده مخروط این آتشفشان 600 کیلومتر و قله آن نسبت به کف اقیانوس که آن را احاطه کردهاست 10 کیلومتر ارتفاع دارد..
بزرگترین آتشفشان کشف بشر بزرگترین آتشفشانی که تا کنون به وسیله بشر کشف شدهاست، الیمپوس مونز یا کوه المپوس نام دارد که در بهرام واقع است. شواهد به دست آمده از طریق عکسبرداریهای سفینهء فضایی نشان میدهد که ارتفاع این آتشفشان احتمالاً 23 کیلومتر بوده و کالدرای آن نیز 65 کیلومتر عرض دارد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تعاریف اصطلاحات آتشفشان
آتشفشان (Volcano)
عبارت است از ساختمان زمین شناسی كه از طریق آن مواد مذاب و گازی و در مواردی همراه با قطعات جامد از اعماق به سطح زمین راه یافته و تجمع این مواد در محل خروج تشكیل بر جستگیهایی بنام آتشفشان می نماید.
ماگما -Magma

ماگما
گدازه (Lava)
ماگما و یا ماده مذاب خارج شده از آتشفشان را گویند. ماگما علاوه بر فاز مایع معمولاً حاوی مواد فرار (فاز گازی ) و یا جامد ( بلورها و قطعات ) ممكن است باشد
جریان گدازه ای (Lava flow)
به مواد گدازه ای روان شده در سطح زمین كه گاه به صورت نهر و یا رودخانه ای از مواد مذاب جلوه می نماید، گفته می شود.
حجره و یا اتاقک ماگمایی (Magma chamber)
به محل تجمع ماده مذاب و یا ماگما در اعماق زمین حجره ماگمایی اطلاق می شود. گاه این مجرای آتشفشانی حالت استوانه ای داشته كه در صورت پر شدن از ماده مذاب و انجماد ایجاد ستون منجمد آتشفشانی (Volcanic necks) می نمایند.
دودكش(plug)
دودكش، راهی است كه ماگمای یك آتشفشان از درون آن عبور میكند. دودكش های آتشفشانی گاه عبارت از شكستگی و یا محل بر خورد شكستگی ها می باشند. اگر در حالت اول شكستگی از ماگما پر شود, پس از انجماد تشكیل یك توده سنگ آذرین صفحه مانند می دهد كه طبقات را قطع نموده اند و بدان دایك Dike)) گفته می شود.
در مواردی نیز ماده مذاب از طریق شكستگی ها بالا آمده و بموازات چینه بندی سنگ ها جایگزین می شود. به این گونه سنگ های آذرین صفحه ای كه در بین لایه ها و به موازات آن ها تشكیل شده اند, سیل (Sill) اطلاق می گردد.
چنان چه ضمن جایگزینی ماده مذاب در بین چینه بندی بخش مركزی دارای تمركز بیشتری از مواد مذاب نسبت به طرفین بوده و تحدب به طرف بالا باشد در این حالت به توده سنگ های آذرین حاصل لاكولیت (Laccolith) گفته می شود.
پوسته (Crust)
پوسته، خارجیترین لایة سنگی زمین است.
حجره ی ماگمایی(Magma Chamber)
حجرة ماگمایی حاوی ماگمای عمیق و درون پوستة زمین است.
دهانه آتشفشان (Volcanic crater)
به محل خروج مواد آتشفشانی در سطح زمین دانه یا (Crater) گفته می شود كه معمولاً بشكل قیف مانند در انتهای دودكش آتشفشانی ملاحظه می گردد.
مخروط آتشفشانی(Volcanic cone)
به برجستگی كه بر اثر انتشار و تجمع مواد آذر آواری ( پیروكلاستیك ) و گدازه ای در اطراف دهانه تشكیل می گردد مخروط آتشفشانی گفته می رود.
مواد آذر آواری یا پیروكلاسلتیك به مواد آتشفشانی پرتاب شده در اثر فوران آتشفشانی ( لخته های مایع نیمه مایع یا خمیری و یا جامد ) اطلاق می گردد .
این مواد ممكن است منحصراً از مواد آذر آواری تشكیل شده باشد كه در این صورت بدان مخروط تفرایی (Tephra cone)می گویند و یا اساسا ً از مواد گدازه ای تشكیل یافته باشد كه بدان مخروط لاوایی (Lava cone) گفته می شود و یا بالاخره تناوبی از مواد گدازه ای و آذر آواری ممكن است باشد كه به این گونه آتشفشان ها استراتوولكان (Stratovolcan)گفته شده می شود.
فوران (Eruption)
به خروج و پرتاب مواد آتشفشانی در سطح زمین فوران گفته می شود. خروج مواد آتشفشانی می تواند از دهانه مركزی آتشفشان و یا از طریق شكاف و احیاناً گروهی از شكاف ها صورت گیرد.
فوران های ماگمایی (Magmatic eruption)
به فورانه ایی گفته می شود كه نتیجه عملكرد مستقیم گازهای ماگمایی و ماگما می باشند
فوران های ناشی از بخار آب یا (Hydro eruption)
این گونه فوران ها ناشی از بخار آب ثانوی بوده كه بواسطه گرم شدن آب های خارجی (یا زیر زمینی) در تماس با ماگما بوجود می آید.چنانچه این آب از منشاء آب های زیر زمینی باشد بدان فراتیك Phreatic می گویند.
دیاترم (Diatreme)
دهانه های انفجاری است كه بواسطه انفجار گازی بوجود آمده است، دیاترم در واقع به صورت دودكش های آتشفشانی پر شده از برش می باشند و شكل حفره ای یا چاه مانند دارند.
كا لدراها (Caldera)
به دهانه های نسبتاً وسیع آتشفشانی گفته می شود كه قطر آنها ممكن است به چندین كیلومتر برسد و شامل كا لدراهای انفجاری, كا لدراهای ریزشی و كا لدراهای فرسایشی هستند.
كا لدراهای انفجاری
این نوع كالدراها بواسطه انفجار حجم عظیم از مواد آتشفشانی و پر سنگ در اثر گازهای تحت فشار حاصل و دهانه های وسیع تشكیل می دهد.
كا لدراهای ریزشی
این نوع كالدراها متداول ترین نوع می باشد كه در اثر انفجار و خارج شدن حجم زیاد از مواد ماگمائی و سنگین قسمت های فوقانی آتشفشان عمل فرو نشت یا ریزش اتفاق میافتد كه همراه با ایجاد شكستگی هائی می باشد.
كا لدراهای فرسایشی
این نوع كالدراها بر اثر فرسایش دهانه های آتشفشان های قدیمی و وسعت یافتن آن ها بوسیله عوامل جوی یا یخچالی و بادی ممكن است حاصل گردد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
سنگ

سنگ از نظر زمینشناسان به مادهی سازندهی پوسته و بخش جامد سستکرهی زمین گفته میشود. سنگها از یک یا چند کانی درست شدهاند و از نظر چگونگی پدید آمدن در سه گروه سنگهای آذرین، سنگهای رسوبی و سنگهای دگرگونی جای میگیرند.
سنگهای آذرین از سرد شدن گدازهی آتشفشانها به وجود میآیند.
سنگهای رسوبی پیامد فرسایش سنگها و انباشته شدن رسوبها در دریاها هستند.
هنگامی که سنگی در فشار و گرمای زیاد قرار گیرد، سنگ دگرگونی پدید میآید.
سنگها و کانیها
کرهی زمین از نظر ویژگیهای فیزیکی ساختار لایهای دارد. بخش مرکزی آن جامد است، بیشتر از آهن و نیکل درست شده و هستهی درونی نامیده میشود. پیرامون هستهی درونی را لایهی مایعی از آهن و نیکل فراگرفته که هستهی بیرونی نام دارد. پیرامون هستهی بیرونی را لایهای به نام گوشته در بر میگیرد که خود از لایهای جامد و سخت به نام گوشتهی زیرین و لایهای نرمتر و خمیری به نام سستکره درست شده است. پیرامون گوشته را لایهی نازک و جامدی به نام پوسته فراگرفته که بیشتر از سیلیس، اکسیژن و آلومینیوم درست شده است. زمینشناسان به مواد طبیعی و بی جان سازندهی پوسته سنگ میگویند و بیرونیترین لایهی زمین را سنگکره مینامند.
سنگها از یک یا چند کانی درست شدهاند. کانی به موادی بیجان، جامد و بلوری گفته می شود که ترکیب شیمیایی به نسبت ثابتی دارند. بیش از 3 هزار گونه کانی در طبیعت یافت شده است که نزدیک 20 تا 25 گونه از آنها در ساختمان بسیاری از سنگها وجود دارند. بیشتر سنگها از چند کانی درست شدهاند، مانند گرانیت که بخش زیادی از آن از سه کانی کوارتز، فلدسپات و بیوتیت است.
هر گروه از سنگها نیز دارای کانیهای مشخصی هستند که در گروه سنگهای دیگر وجود ندارند یا بسیار اندک هستند. برای نمونه، کانی هالیت فقط در سنگهای رسوبی دیده می شود و در سنگهای آذرین یا دگرگونی دیده نمی شود. کانی ولاستونیت نیز فقط در سنگهای دگرگونی یافت می شود. با این همه، برخی از کانی ها، مانند کوارتز، ممکن است در هر گونه سنگی وجود داشته باشند.
سنگها و کانیهای آنها
|
گونهی سنگ |
کانیهایی که در آن یافت میشود |
|
سنگهای آذرین |
ارتوز، پرتیت، میکروکلین، پلاژیوکلاز، کوارتز، نفلین، لوسیت، هورنبلند، اوژیت، بیوتیت، مسکوویت، الیوین |
|
سنگهای رسوبی |
کانیهای رسی ، کلسیت، دولومیت، کوارتز، هالیت، سیلوین، ژیپس، انیدریت،گلوکونیت، اکسیدها(بهویژه آهن)،کربناتهای دیگر |
|
سنگهای دگرگونی |
استرولیت، کیانیت، آندالوزیت، سیلیمانیت، گرونا، ولاستونیت، ترومولیت، کلریت، گرافیت، تالک |
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
سنگهای آذرین

سنگ های آذرین
هرچه بیشتر به ژرفای زمین برویم، دما بالاتر می رود و در ژرفای زیاد به اندازه ای میرسد که برای ذوب شدن سنگها کافی است. با این همه، مواد درونی زمین به حالت مذاب نیستند. چون فشار زیادی که از لایههای بالایی بر لایههای زیرین وارد میشود، از ذوب شدن سنگها جلوگیری میکند. اما در جاهایی از ژرفای زمین که به دلیلی(برای نمونه، در پی جایهجایی ورقههای سنگ کره) از فشار کاسته میشود یا سنگهای سطحی زمین به زیر سطح فرو میروند، سنگها ذوب میشوند. هر جایی که سنگها ذوب شوند، مادهی مذاب، که ماگما نام دارد، به سوی بالا راه پیدا میکند و آرام آرام دمای آن کاهش مییابد و سنگهای آذرین را پدید میآورد.
ماگما ممکن است به بخشهای بالایی پوسته نفوذ کند یا از راه شکافها و سوراخها به سطح پوسته راه یابد. ماگمایی که از سطح پوسته بیرون نمیزند به آهستگی و طی سالها سرد میشود و سنگهای آذرین درونی را میسازد. به ماگمایی که از دهانهی آتشفشان بیرون میآید و به سطح زمین میرسد، گدازه میگویند. همهی حجم گدازهای که به سطح زمین میآید، به حالت مذاب نیست و قطعههای ذوب نشدهی سنگ و کانیهای بلوری را نیز در خود دارد. گدازه طی چند روز سرد میشود و سنگهای آذرین بیرونی را میسازد.
بررسی ترکیب شیمیایی سنگهای آذرین و گدازهی آتشفشانهای فعال، نشان داده است که ماگما یک ترکیب سیلیکاتی با اندکی اکسیدهای فلزی، بخار آب و مواد گازی است. سنگهای آذرین را بر پایهی درصد این مواد در سه گروه گرانیتی(اسیدی)، بازالتی(بازی) و آندزیتی(میانه) جای میدهند.
سنگهای آذرینی مانند ریولیت و داسیت را که محتوای سیلیس آنها بالاست، یعنی بیش از 63 درصد 2 SiO دارند، از گروه سنگهای آذرین اسیدی به شمار میآورند.
سنگهای آذرینی مانند آندزیت که بین 52 تا 63 درصد 2 SiO دارند، از سنگهای آذرین میانه و سنگهایی مانند بازالت و گابرو را که محتوای سیلیسی کمتری دارند، از سنگهای آذرین بازی هستند.
برخی از سنگهای آذرین، مانند پریدوتیت، را که محتوای سیلیسی آنها بسیار پایین است، فرابازی می دانند.
بافت سنگهای آذرین
زمینشناسان در بررسیهای صحرایی، که ابزارهای پیچیدهی آزمایشگاهی در دسترس نیست، از اندازه و آرایش بلورهای سنگ، که بافت سنگ نام دارد، برای توصیف سنگها بهره میگیرند. اصطلاح بافت سنگ هنگام بررسی سنگ زیر میکروسکوپ نیز به کار می رود.
بافت سنگ آذرین علاوه بر این که آن را از سنگها دیگر جدا میکند، ما را از درونی بودن یا بیرونی بودن آن و حتی ژرفایی که سنگ در آنجا از ماگما پدید آمده است، آگاه میسازد.
1. بافت نهانبلورین. بلورها را نمیتوان با چشم غیرمسلح دید. اگر بلورها به اندازهای کوچک باشند که فقط با میکروسکوپ پولاریزان دیده شوند، اصطلاح میکروکریستالین و اگر فقط با میکروسکوپ الکترونی یا پرتوهای ایکس شناسایی شوند، اصطلاح کریپتوکریستالین را به کار میبرند.
2. بافت آشکاربلورین. بلورها درشت و از 2 تا 5 میلی متر هستند. این بافت زمانی پدید میآید که ماگما به آهستگی درون زمین سرد شود.
3. بافت پگماتیتی. گونهای از بافت آشکاربلورین است که اندازهی بلورهای آن بزرگتر از 5 سانتیمتر و حتی چند متر است.
4. بافت پرفیری. گونهای از بافت آشکاربلورین است که دارای بلورهای درشت در زمینهای از بلورهای ریز است. این بافت نتیجهی سرد شدن آهسته زیر سطح زمین و آمدن ناگهانی ماگما به سطح زمین است که نخست با پدیدآمدن بلورهای درشت و سپس با بلورهای ریز همراهی میشود.
5. بافت سوراخدار. در پی سرد شدن تند گدازهای که گاز فراوان در خود دارد، بر سطح زمین پدید میآید. سنگپا نمونهای از این بافت است.
6. بافت شیشهای. در برخی فورانهای آتشفشانی، گدازه به درون آب ریخته میشود و بسیار تند سرد میشود. این گونه سنگها بلور ندارند و بافتی مانند شیشه دارند.
7. بافت آذرآواری. هنگامی که گدازه به صورت ذرههای خاکستر به هوا پرتاب میشود و آن ذرهها به صورت لایهای تهنشین میشوند، سنگهایی را میسازند که ذرههای سازندهی آنها آذرین، ولی تهنشینی آنها شبیه سنگهای رسوبی است.
8. بافت آگلومرا. اگر اندازهی ذرههای پرتابی از دهانهی آتشفشان بزرگ باشد، پس از تهنشین شدن به یکدیگر جوش میخورند و سنگ یکپارچهای را میسازند که آگلومرا نامیده میشود.
خانوادههای سنگهای آذرین
سنگهای آذرین را بر پایهی بافت، درصد سیلیس، رنگ، چگالی، ترکیب شیمیایی و در نظر داشتن ویژگیهای دیگر، طبقهبندی میکنند.

1. خانوادهی گرانیت- ریولیت. گرانیت از شناختهشدهترین سنگهای آذرین درونی است که فراوانی و زیبایی آن پس از صیقل یافتن، باعث شده است که در معماری مورد توجه باشد. نام این سنگ از واژهی لاتین گرانوم به معنای دانهی گندم گرفته شده است، زیرا بیشتر کانیهای آن به اندازهی دانهی گندم است. بافت آن از نوع آشکاربلورین است و بیشتر از فلدسپات پتاسیمدار، پلاژیوکلاز سدیمدار و کوارتز درست شده است.
کانیهای بیوتیت، آمفیبول، هورنبلند و گاهی میکای سفید نیز در ساختمان آن دیده میشود.گرانیتها به رنگهای سفید، خاکستری و صورتی دیده میشوند که برخاسته از نوع فلدسپات آنهاست.
ریولیت از نظر نوع کانیها با گرانیت تفاوت زیادی ندارد و در واقع گرانیتی است که بیرون از پوستهی زمین پدید میآید. ریولیتها رنگ روشنی دارند و چون جهتیافتگی مادهی مذاب را به آسانی میتوان در آنها شناسایی کرد، به این نام خوانده میشوند( ریولیت به معنای جریان یافته است.) در این خانواده سنگهایی با بافت شیشهای نیز وجود دارد که ابسیدین شناختهشدهترین آنهاست.
این سنگ تیرهرنگ است و تیرگی آن به این علت است که هیچ گونه بلوری در آن وجود ندارد. به سنگهای بیرونی با بافت سوراخدار این خانواده، پونس، پامیس یا سنگپا می گویند. توجه داشته باشید که سنگپا ممکن است در خانوادههای دیگر نیز وجود داشته باشد.
2. خانوادهی گرانودیوریت- داسیت. گرانودیوریت یکی از فراوانترین سنگهای آذرین درونی است که از نظر کانی شناسی، در میانهی سنگهای گرانیتی و دیوریتی جای میگیرد. زیرا درصد کوارتز آن اندکی از گرانیت کمتر ولی از دیوریت اندکی بیشتر است. داسیت همانند بیرونی گرانودیوریت است. این سنگ در ایران فراوان است و بیشتر به رنگ روشن دیده می شود.
3. خانوادهی دیوریت- آندزیت. دیوریتها سنگهایی هستند که بیشتر از فلدسپات پلاژیوکلاز سرشار از کلسیم درست شدهاند. این سنگها اغلب کوارتز ندارند، اما گاهی اندکی کوارتز و فلدسپات پتاسیمدار نیز در ساختمان آنها دیده میشود.کانیهای تیرهرنگ دیوریتها اغلب آمفیبول، پیروکسن و بیوتیت است. آندزیت همانند بیرونی دیوریت است که به رنگ خاکستری تیره دیده میشود به صورت سنگپا و آذرآواری نیز وجود دارد.
4. خانوادهی گابرو- بازالت. گابروها سنگهای تیره با چگالی به نسبت بالا هستند که بیشتر از پیروکسن و پلاژیوکلاز کلسیمدار درست شدهاند. البته، ممکن است اندکی الیوین نیز در آنها دیده شود. بازالت همانند بیرونی گابرو است. بازالت و گابرو 75 درصد سنگهای آذرین پوستهی زمین را میسازند. بازالت سوراخدار را اسکوری میگویند که شبیه سنگپاست. بازالت شیشهای نیز وجود دارد که به آنها تاکیلیت میگویند. در پیرامون آتشفشان خاموش دماوند، بهویژه در کنارهی جادهی هراز، میتوان گونههای اسکوری، پرفیری و آگلومرای بازالتی را پیدا کرد.
5. خانوادهی پریدوتیت. پریدوتیت سنگی بسیار بازی است که بیشتر از کانیهای آهن و منیزیمدار درست شده است. پریدوتیتها چگالی بالایی دارند و رنگ آنها تیره است. الیوین فراوانترین کانی پریدوتیتهاست، اما ممکن است اندکی پیروکسن و حتی آمفیبول نیز در آنها دیده شود. پریدوتیتها سرشار از الیوین را دونیت گویند و پریدوتیتهای سرشار از پیروکسن را پیروکسنیت مینامند. در صورتی که هم الیوین و هم پیروکسن را داشته باشند، لرزولیت خوانده میشوند. لمبورژیت، که بسیار کمیاب است و از بلورهای ریز اوژیت(نوعی پیروکسن) و الیوین آهندار درست شده است، همانند بیرونی پریدوتیتهاست و به رنگ قرمز قهوهای دیده می شود. کیمبرلیت را نیز همانند بیرونی آنها میدانند که سرشار از الیوین است و بلورهای ریز و اندکی گرونا(کانی دگرگونی) و الماس دارد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اثرات فرسایش (بخش اول)
فرسایش از عواملی است که بازده زمین کشاورزی را پایین میآورد و در واقع زمین را از بین میبرد. در نتیجه متخصصان باید تمام تلاش خود را برای جلوگیری از پیدایش فرسایش انجام دهند.
فاکتورهای موثر در فرسایش خاک :
الف) عامل انرژی : شدت بارندگی ، حجم رواناب ، نیروی باد ، زاویه شیب ، طول شیب .
ب) عامل مقاومت : فرسایش پذیری خاک ، ظرفیت نفوذ ، مدیریت خاک .
ج) عامل حفاظت : تراکم جمعیت ، پوشش گیاه ، مدیریت زمین .
|
|
اثرات فرسایش :
فرسایش تشدیدی خاک فشارهایی را که به یک خاک برای تولید محصول وارد میشود ، افزایش میدهد. فشارهای وارده میتواند فیزیکی ، شیمیایی و بیولوژیکی میباشد .
اثرات فرسایش بر خصوصیات فیزیکی :
1- کاهش عمق ریشه دهی .
2- کاهش ظرفیت ذخیره آب و خاک .
3- سله بستن و تراکم و سخت شدن خاک .
4- خارج شدن ذرات کلوئیدی و رسی از سطح خاک .
فرسایش باعث توسعه شیارها و گالی ها میشود و همین امر عملیات زراعی را مشکل میکند .

اثر فرسایش بر خصوصیات شیمیایی :
فرسایش حاصلخیزی را کاهش میدهد از جمله اختلالات شیمیایی و تعذیهای مربوط به فرسایش میتوان کاهش CEC (تبادل ظرفیت کاتیونی) کمبود عناصر غذایی NPK و عناصر میکرو را نام برد.
اثر فرسایش بر عملکرد محصول :
کمی کردن اثر فرسایش خاک بر عملکرد محصول، کار پیچیدهای است. به این دلیل که باید ارزیابی دقیقی از اثرات متقابل بین خصوصیات خاک، مشخصات محصول و اقلیم صورت میگیرد. اثرات فرسایش به عملکرد به صورت تجمعی است و حتی مدت ها بعد از شروع فرسایش شدید هم قابل مشاهده نمیباشد. فرسایش خاک، عملکرد محصول و از ظریق اتلاف عناصر غذایی، تخریب ساختمان، کاهش عمق خاک و ظرفیت نگهداری آب خاک کاهش میدهد .
اثرات بیرونی فرسایش خاک :
در بین مهم ترین این اثرات میتوان به رسوب گذاری در مخازن و سدها، کاهش محصول در مناطق واقع شده در پایین دست به خاطر اثرات سیلاب و آلودگی آب ها به وسیله ترکیبات شیمیایی مختلف اشاره کرد. فرسایش خاک به عنوان عامل مهمی در کاهش حاصل خیزی شناخته شده است. حذف خاک از اراضی کشاورزی توسط فرسایش آبی و بادی، پتانسیل طولانی مدت تولید محصول را کاهش میدهد.

اثر فرسایش در ایجاد سیلابهای خطرناك
در مناطقی كه زمین پوشش گیاهی كم دارد یا بكلی فاقد آن است، در موقع بارندگیهای شدید یا ذوب شدن برف ها، آب زیادی در دامنه كوه ها جاری میشود كه اغلب تشكیل سیل های خطرناكی را میدهد.
اثر فرسایش در پر شدن سریع سدها
در حفظ خاك های حوزه آبریز رودهایی كه بر روی آن ها سد بسته شده است، نسبت به رودهایی كه بر روی آن ها سد بسته نشده است باید بیشتر دقت بشود و عملیات حفاظتی به منظور جلوگیری از فرسایش خاك سریعتر و جدیتر و موثرتر باشد، زیرا وجود سد خود در واقع در حكم یك صافی است كه مانع عبور مواد محموله آب میشود. هرچه خاك های حوزه آبریز رود مربوط بیشتر فرسایش یابد، به همان نسبت مواد بیشتری در پشت سدها جمع و روی هم انباشته میشود و در نتیجه عمر سد یعنی مدت بهرهبرداری از آن كوتاه تر میگردد.

اثر فرسایش بر روی كاهش آب های زیرزمینی
پوشش گیاهی نه تنها خاك را حفظ میكند و مانع از فرسایش آن میشود، بلكه در حفظ آب نیز بسیار موثر است. در نقاطی كه زمین پوشش گیاهی دارد (كه این پوشش مانع از فرسایش آن میشود)، به هنگام بارندگی قطرات آب به هنگام فرود آمدن ابتدا به اندام گیاه برخورد میكند و به صورت ذرات ریز در میآید كه بهتر جذب زمین میگردد. از طرف دیگر ریشههای گیاه و هوموس موجود در خاك، آبی را كه به زمین میرسد جذب میكند و به این طریق مانع از جاری شدن آن در سطح زمین میگردد.
آبی كه به طریق مذكور در خاك حفظ میشود بعدها به صورت آب چشمهسار از كف درهها بیرون میآید و آب های دائمی را تشكیل میدهد یا به عنوان آب زیرزمینی در آن محل یا نقاط دورتر از آن ها بهرهبرداری میشود.
به عكس، كوه ها یا زمین های شیبداری كه پوشش گیاهی ندارد و فرسایش یافته است، قادر نیست آب های برف و باران را در خود نگه دارد. چون به همین علت منابع آب های زیرزمینی تغذیه كافی نمیشود، در فصول خشكی قنات ها دچار كم آبی و در شرایط فوقالعاده حتی خشك میگردد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اثرات فرسایش 2
قبلا خواندید که....
اثر فرسایش در كاهش حاصلخیزی خاك
بر اثر فرسایش، خاك روی زمین كه از نظر كشاورزی فعال ترین و بارخیزترین قسمت پوسته جامد زمین است، فرسوده میشود و از بین میرود و در نتیجه حاصلخیزی آن كاهش مییابد. فرسایش چنانچه شدید باشد، به كلی بارخیزی خاك را از بین میبرد.
چنانچه قابلیت نفوذ آب یا هوا در خاك، بر اثر كم شدن یا از بین رفتن ماده آلی و تاثیر سایر عوامل كاهش یابد، خاكدانهها متلاشی و از هم جدا میشود، در نتیجه، ساختمان خاك متراكم میگردد. در چنین حالتی در فصل مرطوب، محیط نامساعد و خفهكنندهای در خاك بوجود میآید. چون در این صورت هوا و آب نمیتواند در خاك نفوذ كند و همچنین خاك قادر نیست آّب را برای فصل خشكی در خود ذخیره نماید، از نظر شیمیایی و بیولوژیكی شرایط در خاك بسیار نامساعد میگردد.
در چنین محیطی به تدریج موجودات كوچك خاكزی (میكروارگانیزمها) از بین میروند و هوموس خاك تلف میشود. بر اثر از بین رفتن مواد آلی (هوموس)، كمبود مواد ازتی خاك نیز ظاهر میگردد. با از بین رفتن هوموس و موجودات زنده، خاك حاصلخیزی خود را به كلی از دست میدهد.

فرسایش تونلی
یكی از جالب ترین و نادرترین ای فرسایش ها، فرسایش تونلی می باشد. این فرسایش در این ناهمواری اشكالی را شبیه به لانه روباه بوجود آورده است كه به نام اشكال فرسایش تونلی معروف هستند. اشكال فرسایش تونلی مطالعه شده در منطقه ساختاری ساده داشته و شامل تعدادی حفره یا گودال های قیفی شكل با ابعاد گوناگون و یك شبكه زهكشی زیرزمینی بوده كه این شبكه توسط خروجی هایی به شكبه زهكشی سطحی متصل است.
فرسایش توده ای
این نوع فرسایش در روی زمین اغلب به شكل عوارض زمین كه معرف حركات خاك در گذشته است ظاهر میگردد. این حركات عبارتست از تورم و بالا آمدن خاك، سرخوردگی، خزیدن زمین و ریزش خاك (حركت یخچال ها).
در فرسایش تودهای قسمتی از خاك دامنه كوه ها به حركت در میآید كه یا ممكن است بر اثر اشباع شدن خاك طبقه رویی از آب و نفوذپذیری خاك طبقه زیری، خاك رویی به حركت در آید، یا ممكن است بر اثر لغزش این عمل اتفاق افتد، به این معنی كه تودهای از كوه از محل اولیه خود جدا میشود و در محل دیگری قرار میگیرد، یا ممكن است در نتیجه ریزش باشد كه در این حالت قسمتی از كوه ریزش میكند و در سطحهای پایینتر روی هم انباشته میشود.

فرسایش سیلابی
فرسایش سیلابی یك تخریب ساده نیست. در مناطق كوهستانی و حتی در زمین های سست جلگهای فرسایش شیاری و خندقی ممكن است به فرسایش سیلابی تبدیل گردد. در این فرسایش جریان آب به ویژه آبهای گلآلود، حامل ریگ و شن و غیره، موجب شسته شدن اطراف آن و حمل مواد بیشتر با خود میگردد. با این عمل، زمین های دیواره ی بستر، استحكام و قدرت خود را از دست میدهد و بتدریج و در مواقع جاری شدن سیلاب های شدید حتی به طور ناگهانی ریزش میكند و امكان دارد كه موجب تخریب و ویرانی مزارع و دهاتی كه در جوار این مسیلها واقع شدهاند، بشود. با افزایش مواد خاكی در آب، وزن مخصوص آن بیشتر و قدرت و نیروی درهم كوبنده آن زیادتر میگردد.
فرسایش خندقی
منشا این فرسایش، آب است. در این فرسایش عمق و عرض زمین های فرسایش یافته بیشتر از فرسایش شیاری است.
این شكل فرسایش، بر اثر پیشرفت فرسایش شیاری بوجود میآید، به این نحو كه شیارها به هم میپیوندند، در نتیجه زمین بیشتر شسته میشود و نهرها یا خندق هایی در سطح زمین تشكیل میگردد.
در این تخریب، سنگ مادر ظاهر میشود و آنقدر عمیق و عریض است كه گاوآهن قادر به عبور از آنها نیست. این خندق ها یا نهرها تدریجا عمیقتر میشوند. عمق خندق ها به یك متر یا بیشتر میرسد و بتدریج شكل آن ها تغییر میكند. این عمل در صخرههای سست، خاك های رسی و رسی آهكی بیشتر دیده میشود.
این فرسایش اغلب در محدوده آب و هوای خشك و در نواحی كه تغییرات درجه حرارت در فصول مختلف در آنجا شدید است ظاهر میگردد. البته این شكل تخریب در زمین های جنگلكاری شده نیز دیده میشود و ساختمان زمینشناسی خاك هم در این فرسایش بیتاثیر نیست.

فرسایش چاله ی
این شكل فرسایش بیشتر منشا بادی دارد. چاله ها در نتیجه توسعه فرسایش سطحی و بزرگتر شدن چاله های كوچك نخستین، بوجود می آید. در بسیاری از نقاط دشت لوط و حواشی دشت كویر سطحهای وسیعی از زمین دیده میشود كه بر اثر باد بصورت چاله چاله در آمده است. این چاله ها نشانه فرسایش بادی شدید در این نواحی است. بادهای شدید موادی را كه از كندن این چالهها بدست می آورد، كیلومترها با خود میبرد.
فرسایش شیاری یا آبراهه ای
منشا این تخریب اغلب باران است و در پیدایش آن عامل، شیب بسیار موثر می باشد. فرسایش شیاری یا آبراهه ای، در دامنه كوه ها و حتی در سطح زمین های كم شیب نیز به سهولت دیده میشود. این شكل فرسایش، پیشرفته تر از فرسایش سفرهای بوده و ممكن است به صورت خطوط موازی نیز ظاهر شود كه ابتدا كم عمق است ولی به سرعت عمیق تر میشود. این شكل فرسایش، تا زمانی كه سنگ مادر ظاهر نشده است، بنام فرسایش شیاری خوانده میشود.
فرسایش سطحی یا سفره ای
عمل عامل فرسایشی در این فرسایش، در تمام سطح زمین است. این شكل فرسایش بیشتر منشا بادی دارد، ولی طبیعی است كه فرسایش آبی نیز ابتدا به طور سطحی اتفاق می افتدكه به علت فرسایش یكنواخت در تمام سطح كمتر محسوس می گردد.
این نوع تخریب با ظهور لكه های سفید و روشن در سطح نمودار میشود و نشان دهنده تخریب و از بین رفتن سطحیترین قسمت زمین، آن هم به صورت لكه لكه است. اختلاف رنگ بین قسمت های فرسایش یافته و فرسایش نیافته علامت این تخریب است، زیرا قسمت رویی به علت دارا بودن مواد آلی، غالبا تیره رنگ میباشد.
علامت دیگر این فرسایش وجود ریگ و سنگریزه های آزاد در سطح زمین است. در این نقاط باد ذرات ریز را با خود برده و ریگ و سنگریزه در سطح زمین باقی مانده است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
فرسایش خاک
فرسایش كه به آلمانی Abtrag و به فرانسه و انگلیسی Erosion گفته میشود، از كلمه لاتین Erodere گرفته شده و عبارت است از فرسودگی و از بین رفتگی مداوم خاك سطح زمین (انتقال یا حركت آن از نقطه ای به نقطه دیگر در سطح زمین) توسط آب یا باد.

خاك یكی از مهم ترین منابع طبیعی هر كشور است. فرسایش نه تنها سبب فقیر شدن خاك و متروك شدن مزارع می گردد و از این راه خسارات زیاد و جبران ناپذیری را به جا می گذارد، بلكه با رسوب مواد در آبراهه ها، مخازن سدها، بنادر و كاهش ظرفیت آبگیری آن ها نیز زیان های فراوانی را سبب میگردد. بنابر این نباید مساله حفاظت و حراست خاك را كوچك و كم اهمیت شمرد.

اگر استفاده خاك بر اساس شناسایی استعداد و قدرت تولیدی آن و مبتنی بر رعایت اصول صحیح و علمی باشد، خاك از بین نمی رود. فقط در سایه حمایت پوشش نباتی(درختان یا سایر گیاهان) بوده كه فرسایش خاك بسیار كند شده و تعادلی در تشكیل و فرسایش خاك ایجاد گردیده است.
این تعادل مساعد كه تحت تاثیرشرایط طبیعی حكمروا شده بود، از زمانی كه بشر زمین را به منظور تهیه محصول و به دست آوردن غذا و دیگر مایحتاج خود، مورد كشت و زرع قرار داد تا از آن به عنوان مرتع استفاده كرد، بر هم خورد و زمین ها در معرض فرسایش شدید و وسیع قرار گرفت.
بنابراین فرسایش قبل از آن كه مورد بهره برداری انسان قرارگیرد نیز اتفاق میافتاده (فرسایش طبیعی) ولی از وقتی كه انسان در آن به كشت و زرع پرداخت باعث فرسایش بیش از حد(فرسایش سریع وشدید) خاك شده است.

مبارزه با فرسایش آبی
معمولا برای حفظ خاك و مبارزه با فرسایش دو راه وجود دارد: مبارزه مستقیم و مبارزه غیر مستقیم.
این دو روش مبارزه نمیتوانند جایگزین یكدیگر شوند، بلكه به صورت مكمل میباشند. استفاده از فعالیت های مدیریتی در قالب مدیریت جامع حوزههای آبخیز، روشی مناسب در كنترل و كاهش میزان فرسایش و رسوب است.
در مبارزه غیر مستقیم هدف ایجاد پوشش گیاهی یا بیشتر كردن آن است. برای نتیجه گیری بهتر، بایستی روش بهرهبرداری از زمین با حفظ خاك متناسب باشد و به جهت ایجاد تعادل بین خاك و گیاه و زمین های مرتعی و جنگلی و زراعتی مشخص گردد تا نقاطی كه استعداد جنگل را دارد، جنگلكاری، و قسمت هایی كه برای مرتعداری مناسب است، در آن جا پوشش مرتعی ایجاد یا توسعه داده شود و خلاصه سطحهایی كه برای كشاورزی مستعد است، گیاهان زراعتی مناسب با آن محل به ویژه از خانواده لگومینوز كاشته بشود.
هر چند گیاهان زراعتی خاك را به خوبی مرتع و جنگل در برابر عوامل فرسایشی حفظ نمیكنند، اما چون خاك استعداد كشاورزی دارد، چنان چه از روی اصول صحیح كشت و زرع گردد، هم از لحاظ اقتصادی مقرون به صرفه است و هم خاك حفظ خواهد شد.

در بهرهبرداری صحیح از خاك در نقاط كوهستانی معمولا باید نكات ذیل مراعات بشود:
زمین هایی كه شیب آن ها زیاد و صخرهای است و هم چنین سطح هایی كه خاكش كم است، مانند قله كوه ها را باید به احداث جنگل اختصاص داد تا حساسیت خاك در مقابل فرسایش كم شود و زمین هایی كه دارای خاك نرم و مرطوب و كوهپایهای است و نسبت به زمین های جنگلی شیب كمتری دارد در آن ها مرتع به وجود آورد و خلاصه اراضی كه خاكش خوب و شیب آن كم است و دسترسی به آب آبیاری لازم هم هست، با احتیاط و از روی اسلوب صحیح كشاورزی بشود.
در این جا قابل ذكر است كه بسیاری از كارشناسانی كه برنامه آبخیزداری را اجرا میكنند معتقدند در نقاطی كه منظور، حفظ خاك است، به هیچ وجه نباید زراعت بشود، كما این كه در ایران در كلیه حوزههای آبخیزداری بكلی مانع بهرهبرداری از زمین به صورت كشاورزی و برای دامداری میشوند، زیرا شخم زدن زمین و هم چنین بدون پوشش گیاهی ماندن آن برای مدتی از سال به فرسایش خاك كمك میكند.
مبارزه غیر مستقیم یعنی ایجاد پوشش گیاهی یا تقویت پوشش زنده خاك بیشتر به منظور پیشگیری صورت میگیرد، در صورتی كه مبارزه مستقیم هنگامی شروع میشود كه خاك فرسایش یافته باشد و باید اقداماتی انجام داد كه خاك بیش از این فرسایش نیابد و امكاناتی فراهم كرد تا سطوح فرسایش یافته ترمیم گردد. بنابراین در مبارزه مستقیم وضع خاك از نظر فرسایش از مرحله پیشگیری به مرحله استعلاجی میرسد كه انجام این امر مستلزم صرف هزینه زیاد است و اصل اقتصادی آن بایستی مراعات گردد.
فرسایش آبی موقعی اتفاق میافتد كه سرعت آب های جاری از سرعت آستانه فرسایش تجاوز كند. سرعت آستانه فرسایش، حداقل سرعتی است كه آب بتواند ذرات خاك را با خود حمل كند. در مبارزه مستقیم با فرسایش آبی، هدف نفوذ دادن آب بیشتر در زمین، یا هدایت آب های اضافی به طرف مجاری خروجی و خلاصه جلوگیری از سرعت آب های جاری در سطح زمین است تا به سرعت آستانه فرسایش نرسد كه موجب فرسایش خاك گردد.
مبارزه مستقیم با فرسایش را معمولا از طریق ایجاد بانكتهای افقی در امتداد خطوط تراز و ایجاد سكوهای محافظ و حایل و دیگر اقداماتی كه بعدا به آن ها اشاره خواهد شد، انجام میدهند.

مبارزه با فرسایش خاك
همان طور كه قبلا شرح داده شد، خاك توسط آب و باد فرسایش مییابد. پوشش گیاهی و هوموس در جلوگیری از هر دو نوع فرسایش ( آبی و بادی ) بسیار موثر است.
برای جلوگیری از فرسایش خاك در درجه اول باید هدف ایجاد پوشش گیاهی باشد. اما بدیهی است كه در بعضی نقاط، شرایط طبیعی طوری است كه امكان روییدن گیاه نیست ولی در هر حال باید اقداماتی در زمینه جلوگیری از فرسایش خاك صورت گیرد.
در این شرایط بایستی از فكر ایجاد پوشش گیاهی در آن منطقه منصرف شد و روش های دیگری را برای نفوذ دادن آب در زمین (در فرسایش آبی) و تثبیت خاك در فرسایش آبی و بادی در پیش گرفت. به عنوان مثال حفر جوی ها یا بانكتها در دامنه كوه ها در جلوگیری از فرسایش آبی و استعمال مالچ نفتی در تثبیت ماسههای روان و دیگر اقدامات كه ذیلا به شرح آن ها خواهیم پرداخت.

لازم به ذكر است كه اقدامات لازم درباره جلوگیری از فرسایش خاك و انتخاب روش و به كار بردن وسیله صحیح برای مبارزه با آن باید با مطالعات و بررسی های دقیق و توجه به وضع اقلیمی و جغرافیایی و حتی اجتماعی منطقه مربوطه صورت گیرد نه آن كه یك فرمول و یك دستورالعمل برای مبارزه با فرسایش بادی برای كلیه نقاط به كار برده شود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
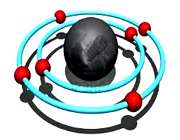
ساختار اتم
در آزمایش ها نیز مشخص گردید که اتم ها نیز خود از ذرات کوچک تری ساخته شده اند. در مرکز یک هسته کوچک مرکزی مثبت متشکل از ذرات هسته ( پروتون ها و نوترون ها) و بقیه اتم فقط از پوسته های متموج الکترون تشکیل شده است. معمولا اتم های با تعداد مساوی الکترون و پروتون، از نظر الکتریکی خنثی هستند.
ذرات سازنده اتم
الکترون: دارای بار منفی و جرم ناچیز است و به دور هسته می چرخند
پروتون: دارای بار مثبت و جرمی معادل 1840 برابر الکترون و تعیین کننده نوع اتم نوترون: بدون بار الکتریکی (خنثی) با جرمی معادل جرم پروتون
عدد اتمی (Z)
به تعداد پروتون های هر اتم(به تعداد بارهای مثبت اتم) عدد اتمی می گویند برای مثال اتم سدیم 11 پروتون دارد, پس عدد اتمی سدیم 11 است. عدد اتمی را گوشه پایین سمت چپ نماد شیمیایی می نویسند 11Na
عدد جرمی (A)
به مجموع تعداد پروتون ها و نوترون های یك اتم عدد جرمی گفته می شود.
تمام اتم های یك عنصر پروتون های یكسان دارند اما تعداد نوترون های آن ها می تواند متفاوت باشد.
عدد جرمی در گوشه بالا و سمت چپ نماد شیمیایی نوشته می شود مثلا اتم كربن در هسته خود 6 پروتون و 6 نوترون دارد پس عدد جرمی آن 12 است. 12C
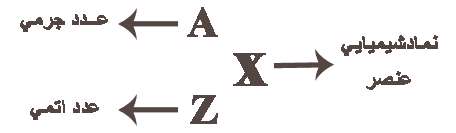
شیمیدان ها برای بیان جرم عنصرها بدین صورت عمل کردند که: فراوان ترین ایزوتوپ کربن یعنی کربن 12 را به عنوان استاندارد انتخاب کردند و جرم عنصرهای دیگر را با استفاده از نسبت هایی که در محاسبات آزمایشگاهی بدست آمده بود، بیان کردند.
به عنوان مثال جرم اتم اکسیژن 33/1 برابر جرم اتم کربن است. با توجه به این که جرم اتم کربن 12 می باشد جرم اتم اکسیژن را محاسبه کرد. در این مقیاس جرم اتم اکسیژن برابر 16خواهد شد.
واحد جرم اتمی amu است که کوتاه شده ی عبارت atomic mass unitاست. در این مقیاس جرم پروتون و نوترون lamu است.
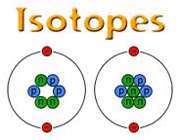
ایزوتوپ
ایزوتوپ ها، اتم های یك عنصر هستند كه در تعداد نوترون و در نتیجه عدد جرمی با هم تفاوت دارند اما عدد اتمی آن ها یكسان است.
مثلا هیدروژن دارای سه ایزوپ است.

بیشتر عناصر، یك ایزوتوپ معمول و چند ایزوتوپ كمیاب دارند به ایزوتوپ های كمیاب تر ناخالصی های ایزوتوپی می گویند.
مثلا ایزوتوپ معمول ئیدروژن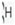 است كه 9/99 درصد كل هیدروژن های موجود در طبیعت را شامل می شود. كم تر از 1/0 درصد را
است كه 9/99 درصد كل هیدروژن های موجود در طبیعت را شامل می شود. كم تر از 1/0 درصد را 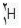 و مقدار ناچیزی را
و مقدار ناچیزی را 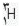 شامل می شود.
شامل می شود.

هنگامی که به وسیله اتم، یک یا چند الکترون از یک اتم دیگر جدا می گردد، یون ها ایجاد می شوند. یون ها اتم هایی هستند که به علت عدم تساوی تعداد پروتو ن ها و الکترون ها، دارای بار الکتریکی ویژه می شوند. یون هایی که الکترون(ها) را بر می دارند، آنیون (anion) نامیده شده و بار منفی دارند.
اتمی که الکترون(ها) را از دست می دهد کاتیون (cation) نامیده شده و بار مثبت دارد. کاتیون ها و آنیون ها به علت نیروی کولمبیک(coulombic) میان بارهای مثبت و منفی، یکدیگر را جذب می نمایند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال اتمی
از نظر لغوی اوربیتال به معنای خانه الکترون میباشد و ناحیهای است که احتمال یافتن الکترون در آن زیاد است. معادله شرودینگر پایه مکانیک موجی است. این معادله بر حسب یک تابع موجی سای برای الکترون نوشته میشود. از حل معادله شرودینگر اتم هیدروژن یک سلسله جواب به عنوان تابع موج بدست میآید. تابع موج ناحیهای در اطراف هسته را نشان میدهد که در آن ناحیه، احتمال یافتن الکترون وجود دارد.
اوربیتال محدودهای از فضای اطراف هسته میباشد که احتمال یافتن الکترون در آن وجود دارد. این احتمال در نزدیکی هسته بیش ترین مقدار را دارد. ولی برای تمام نقاطی از فضا که فاصله معینی از هسته دارند، احتمال معینی وجود دارد. هر اوربیتال میتواند حداکثر دو الکترون را در خود جای دهد. دو الکترونی که در یک اوربیتال جای میگیرند، دارای اسپین مخالف هستند.
هر الکترون را میتوان با چهار عدد کوانتومی مشخص کرد که به منزله شناسنامه الکترون هستند و فاصله نسبی الکترون از هسته (n)، لایه فرعی و شکل اوربیتال (L) ، جهت گیری اوربیتال در فضا (s) را بیان میکنند.
تفسیر مکانیکی اوربیتال
شدت هر موج با مجذور دامنه آن متناسب است. تابع موجی (سای) ، تابع دامنه است. مجذور دامنه یا مجذور تابع موجی برای یک حجم کوچک در هر موقعیتی از فضا با چگالی بار الکترونی در آن حجم متناسب است.
میتوان تصور کرد که بار الکترونی به سبب حرکت سریع الکترون به صورت ابر باردار در فضای دور هسته گسترده شده است. این ابر در برخی نواحی غلیظ تر از برخی نواحی دیگر است. احتمال یافتن الکترون در هر ناحیه معین متناسب با چگالی ابر الکترونی در آن ناحیه است. این احتمال در ناحیهای که ابر الکترونی غلیظ تر باشد، بیشتر خواهد بود.
این تفسیر کوششی برای توصیف مسیر الکترون به عمل نمی آورد، بلکه فقط پیشبینی میکند که احتمال یافتن الکترون در کجا بیشتر است. از نظر مکانیک کوانتومی هیچ محدودیتی برای وجود الکترون در فضا اطراف هسته وجود ندارد. پس بینهایت اوربیتال وجود دارد.
اعداد کوانتومی
مکانیک موجی که نظریه شرودینگر اساس آن میباشد با استفاده از چهار عدد کوانتومی وضعیت الکترون را توصیف میکند. این اعداد عبارتند از :
عدد کوانتومی اصلی
این عدد نشاندهنده ترازهای انرژی است که الکترونها در آن ترازها به دور هسته گردش میکنند و عدد صحیحی میباشد. این عدد میتواند کلیه مقادیر اعداد صحیح مثبت به جز صفر را قبول کند.
عدد کوانتومی اندازه حرکت زاویهای مداری
آرنولد زمر فیلد در سال 1916 پیشنهاد کرد که هر مدار بور (n) با شرط n>1 از لایههایی فرعی با اختلاف انرژی کم تشکیل شدهاست. به هر لایه فرعی یک عدد کوانتومی (L) نسبت داده میشود. این عدد نشان دهنده شکل هندسی توزیع تابع احتمال پیدا کردن الکترون در فضای اطراف هسته میباشد و کلیه مقادیر L=0,1,2, … , n-1 را اختیار کند.
عدد کوانتومی مغناطیسی مداری
تعداد اوربیتالهای یک تراز فرعی را میتوان از این عدد استنتاج کرد که در اثر میدان مغناطیسی هر تراز (L ) به این ترازها شکافته میشود.
به عنوان مثال میدان مغناطیسی بر اوربیتال کروی S که با عدد L=0 مشخص میشود، تاثیری ندارد چون S تقارن کروی دارد و در تمام جهتها بطور یکسان تحت تاثیر خطوط نیرو قرار میگیرد. این عدد که با m نشان داده می شود، مقادیر ممکن این عدد عبارتند از : m=+L,…,0,…,-L
عدد کوانتومی مغناطیسی اسپینی
این عدد مشخص کننده حرکت تقدیمی الکترون است و با نشان داده میشود، و میتواند مقادیر-1/2,+1/2 را اختیار کند.
ابر الکترونی و مکان الکترون
در مورد یک الکترون در حالت n=1 اتم هیدروژن، ابر باردار بالاترین چگالی را در نزدیکی هسته دارد و به تدریج که فاصله از هسته افزایش مییابد، رقیقتر میشود. احتمال یافتن الکترون در حجم کوچکی از فضا، در نزدیکی هسته، بیشترین مقدار را دارد و با افزایش فاصله از هسته به سمت صفر میل میکند.
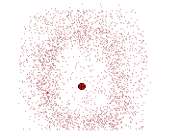
لایههای کروی بسیار نازکی را که یکی پس از دیگری به طور متحدالمرکز به دور هسته قرار دارند، تصور کنید. احتمال یافتن الکترون در واحد حجم فضای نزدیک به هسته بیش ترین مقدار خود را دارد. ولی در عوض یک لایه نزدیک به هسته، در مقایسه با لایههای دورتر، تعداد کم تری واحد حجم را در بر میگیرد. احتمال شعاعی هر دو این عوامل را با هم به حساب میآورد.
انواع اوربیتال
اوربیتال S
اوربیتالهای S دارای تقارن کروی میباشد، تراز n=1 حداکثر دارای دو الکترون است. بنابراین تراز فرعی 1S و 2S و 3S و... هم تقارن کروی دارند، با این تفاوت که اندازه آن ها بزرگتر از اوربیتال 1S میباشد.
اوربیتال p
اوربیتال p از سه اوربیتال فرعی تشکیل شده است. هر اوربیتال p به شکل دو کره تغییر شکل یافته است که میتوان آن ها را در امتداد یکی از محورهای سه گانه مختصات ( z,y,x) تصور کرد از این رو اوربیتالهای p را با مشخص میکنند که در سه جهت مختلف قرار گرفتهاند.
اوربیتالهای p از لحاظ انرژی برابرند و در غیاب میدان مغناطیسی نمیتوان تفاوتی بین الکترونهایی که این اوربیتالها را اشغال کردهاند، قایل شد. ولی در بررسیهای طیفی که تحت تأثیر یک میدان مغناطیسی قرار میگیرند. هر اوربیتال به سه خط شکافته میشوند.
اوربیتال d
اوربیتالهای d از 5 اوربیتال فرعی تشکیل شدهاند که جهت گیریهای متفاوتی در فضا دارند ولی از لحاظ انرژی باهم همارز هستند.
درجه انحطاط
تعداد الکترون هایی که مقدار انرژی برابر داشته باشند، درجه انحطاط یا چندگانگی نامیده میشوند. حداکثر تعداد الکترون های هر تراز از فرمول 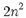 بدست می آید.
بدست می آید.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
حقایقی درباره الماس
با مطالعه حقایق مربوط به الماس، به اطلاعاتی چون الماس های خون گرفته تا فن آوری در زمینه الماس مصنوعی ( ترکیبی ) پی ببرید. از ویژگی های الماس اطلاع حاصل کنید و به کاربردهای آن، ساختار و اتم ها و جواهرات تا زمینه های مختلف اطلاعات و حقایق دیگری به دست بیاورید.

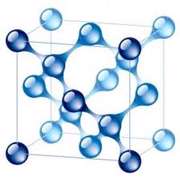
 الماس یکی دیگر از اشکال کربن است.
الماس یکی دیگر از اشکال کربن است. الماس از کلمه یونانی به معنای شکست ناپذیر گرفته شده است.
الماس از کلمه یونانی به معنای شکست ناپذیر گرفته شده است.
 اتم های کربن موجود در الماس در یک ساختار محکم و پیوندی چهارگانه قرار گرفته اند.
اتم های کربن موجود در الماس در یک ساختار محکم و پیوندی چهارگانه قرار گرفته اند.
 الماس سخت ترین ماده طبیعی شناخته شده است که در برش های صنعتی و ابزار صیقل دادن مورد استفاده قرار می گیرد.
الماس سخت ترین ماده طبیعی شناخته شده است که در برش های صنعتی و ابزار صیقل دادن مورد استفاده قرار می گیرد.
 در درجه مقیاس سختی مواد معدنی ( Mohs ) ، الماس شماره 10 را به خود اختصاص داده است که در این مقیاس 1 به نرم ترین ماده ( که طلا است ) و 10 به سخت ترین ماده که الماس است تعلق دارد.
در درجه مقیاس سختی مواد معدنی ( Mohs ) ، الماس شماره 10 را به خود اختصاص داده است که در این مقیاس 1 به نرم ترین ماده ( که طلا است ) و 10 به سخت ترین ماده که الماس است تعلق دارد.
 درمقایسه با دیگر مواد موجود در طبیعت الماس یکی از بهترین هادی های حرارتی است.
درمقایسه با دیگر مواد موجود در طبیعت الماس یکی از بهترین هادی های حرارتی است.
 تحت شرایط عادی، فشار و دمای موجود در سطح زمین، الماس به طور دما پویا بی ثبات است و به آسانی تبدیل به گرافیت می شود. بله درست متوجه شده اید الماس ها تبدیل به گرافیت می شوند. اما مراحل این تبدیل به قدری آهسته صورت می گیرد که ما متوجه آن نمی شویم.
تحت شرایط عادی، فشار و دمای موجود در سطح زمین، الماس به طور دما پویا بی ثبات است و به آسانی تبدیل به گرافیت می شود. بله درست متوجه شده اید الماس ها تبدیل به گرافیت می شوند. اما مراحل این تبدیل به قدری آهسته صورت می گیرد که ما متوجه آن نمی شویم.
 اکثر ذخایر طبیعی موجود الماس در افریقا قرار دارد.
اکثر ذخایر طبیعی موجود الماس در افریقا قرار دارد.
 هرساله حدود 26000 کیلوگرم معادل (57000 پوند ) در سراسر دنیا الماس استخراج می شود که ارزش آن ها برای کمپانی های پر قدرتی که تولید الماس را تحت کنترل دارند میلیون ها دلار است.
هرساله حدود 26000 کیلوگرم معادل (57000 پوند ) در سراسر دنیا الماس استخراج می شود که ارزش آن ها برای کمپانی های پر قدرتی که تولید الماس را تحت کنترل دارند میلیون ها دلار است.
بعد از سنگ Jemstone ، الماس یکی از پرطرفدارترین سنگ هاست که متناوباً در جواهراتی مثل انگشتر و گردنبند استفاده می شود علاوه بر نایاب بودن الماس، این سنگ به آسانی در جواهرات جایگزین می شود، به راحتی قابل براق شدن است و تنها توسط الماسی دیگر قابل خراشیدن است.
 الماس ها بادقت قابل ملاحظه ای بریده شده تا هر قطعه خاص از الماس جلای خیره کننده و قابل توجهی داشته باشد.
الماس ها بادقت قابل ملاحظه ای بریده شده تا هر قطعه خاص از الماس جلای خیره کننده و قابل توجهی داشته باشد.
 هر الماس به نسبت برش آن ها، رنگ، عیار و شفافیت قیمت گذاری می شود.
هر الماس به نسبت برش آن ها، رنگ، عیار و شفافیت قیمت گذاری می شود.
 طی سال ها الماس های زیادی که بسیار گران قیمت نیز بوده اند معروف شده اند که چهارتای آن ها به ترتیب زیر است.
طی سال ها الماس های زیادی که بسیار گران قیمت نیز بوده اند معروف شده اند که چهارتای آن ها به ترتیب زیر است.
 الماس کوه نور که در هند پیدا شد و زمانی فکر می کردند که بزرگترین الماس دنیا است . الان بخشی از جواهرات تاج ملکه انگلیس است که در تاور لندن قرار دارد.
الماس کوه نور که در هند پیدا شد و زمانی فکر می کردند که بزرگترین الماس دنیا است . الان بخشی از جواهرات تاج ملکه انگلیس است که در تاور لندن قرار دارد.
 الماس Hope (آرزو ) که قیرات آن 52/45 است و به دلیل وجود برون (Boroun) در ساختار کریستالی آن به رنگ آبی است.
الماس Hope (آرزو ) که قیرات آن 52/45 است و به دلیل وجود برون (Boroun) در ساختار کریستالی آن به رنگ آبی است.
 درمعدن کیمبرلی در جنوب افریقا ، الماس زرد رنگ تیفانی به وزن حیرت انگیز 42/287 پیدا شد که بعدها به خریدار جواهری به نام چارلز تیفنی در نیویورک فروخته شد و بعدها آن را به شکل بالشتکی به عیار 54/128 (معادل 708/25 گرم ) و 90 تراش برای نشان دادن زیبایی آن برش دادند.
درمعدن کیمبرلی در جنوب افریقا ، الماس زرد رنگ تیفانی به وزن حیرت انگیز 42/287 پیدا شد که بعدها به خریدار جواهری به نام چارلز تیفنی در نیویورک فروخته شد و بعدها آن را به شکل بالشتکی به عیار 54/128 (معادل 708/25 گرم ) و 90 تراش برای نشان دادن زیبایی آن برش دادند.
 این الماس توسط یک برده در یکی از معدن های هند پیدا شد 64/140 قیرات داشت. (1/28 گرم ) این الماس که Regret نامیده شد، درگیر با یک داستان حماسی که در آن یک تاجر دریایی انگلیسی و یک شاهزاده فرانسوی دخیل بودند شد.
این الماس توسط یک برده در یکی از معدن های هند پیدا شد 64/140 قیرات داشت. (1/28 گرم ) این الماس که Regret نامیده شد، درگیر با یک داستان حماسی که در آن یک تاجر دریایی انگلیسی و یک شاهزاده فرانسوی دخیل بودند شد.
الآن در موزه لوور فرانسه از سال 1887 به معرض نمایش گذاشته شده است.

 الماس در فرم طبیعی آن بیلیون ها سال تحت فشار و گرمای زیاد طول می کشد تا شکل بگیرد. آن ها اغلب با یک فوران آتش نشانی به روی سطح زمین آورده می شوند.
الماس در فرم طبیعی آن بیلیون ها سال تحت فشار و گرمای زیاد طول می کشد تا شکل بگیرد. آن ها اغلب با یک فوران آتش نشانی به روی سطح زمین آورده می شوند.
 در سال 1940 تحقیقاتی درباره تکنولوژی الماس ترکیبی صورت گرفت ودرسال 1950اولین الماس ترکیبی تولید شد.
در سال 1940 تحقیقاتی درباره تکنولوژی الماس ترکیبی صورت گرفت ودرسال 1950اولین الماس ترکیبی تولید شد.
 شیوه های مختلفی برای ایجاد الماس ترکیبی وجود دارد که شامل ترکیب فشار زیاد و دمای زیاد ، تبخیر شیمیایی و انفجار ترکیبی ( منفجر کردن واقعی کربن برای به وجود آمدن دانه های بسیار ریز الماس ).
شیوه های مختلفی برای ایجاد الماس ترکیبی وجود دارد که شامل ترکیب فشار زیاد و دمای زیاد ، تبخیر شیمیایی و انفجار ترکیبی ( منفجر کردن واقعی کربن برای به وجود آمدن دانه های بسیار ریز الماس ).
 این ماده ترکیبی که به عنوان مربع زیرکونیا شناخته شده است یک شکل کریستالی از دی اکسید زیرکونیوم است (ZrO2) . به دلیل ویژگی هایش که علاوه بر سختی آن، بدون عیب و بدون رنگ بودن آن، همچنین ارزان و بادوام نیز هست الماس نام گرفته است.
این ماده ترکیبی که به عنوان مربع زیرکونیا شناخته شده است یک شکل کریستالی از دی اکسید زیرکونیوم است (ZrO2) . به دلیل ویژگی هایش که علاوه بر سختی آن، بدون عیب و بدون رنگ بودن آن، همچنین ارزان و بادوام نیز هست الماس نام گرفته است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
حقایقی در باره نیتروژن
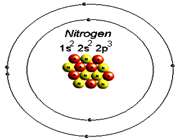
حقایق جالب توجه مربوط به نیتروژن را مطالعه کنید و درباره گازی که هوای قابل تنفس برای شما را فراهم می سازد بیش تر بدانید.
نیتروژن عنصری خارق العاده است که دارای ویژگی های منحصر به فرد است و در مواد منفجره، داروهای بیهوشی، باروری، و هم چنین مسابقات ماشین سواری مورد استفاده قرار می گیرد.
با مطالعه حقایق جالب توجه در باره اتم نیتروژن، نیتروژن مایع ، اکسید نیتروژن اسید نیتریک و نیتروگلیسرین و چیزهای دیگر آگاه شوید.
 نیتروژن عنصری شیمیایی با علامت اختصاری N است که عدد اتمی آن 7 می باشد.
نیتروژن عنصری شیمیایی با علامت اختصاری N است که عدد اتمی آن 7 می باشد. تحت شرایط معمولی نیتروژن گازی بدون رنگ، بو و مزه است .
تحت شرایط معمولی نیتروژن گازی بدون رنگ، بو و مزه است .

 نزدیک به 78% از هوایی که تنفس می کنیم از نیتروژن تشکیل شده است.
نزدیک به 78% از هوایی که تنفس می کنیم از نیتروژن تشکیل شده است.
 نیتروژن در همه موجودات زنده از جمله بدن انسان و گیاهان وجود دارد.
نیتروژن در همه موجودات زنده از جمله بدن انسان و گیاهان وجود دارد.
نیتروژن برای نگه داشتن طولانی مدت غذا به صورت بسته بندی و یا فله کاربرد دارد. هم چنین برای ساخت قطعات  الکترونیکی، اهداف صنعتی و بسیاری مقاصد مفید دیگر استفاده دارد.
الکترونیکی، اهداف صنعتی و بسیاری مقاصد مفید دیگر استفاده دارد.
 بیش از 98% اتمسفری که تیتان (TITAN ) بزرگ ترین ماه زحل را دربر گرفته است از نیتروژن تشکیل شده است. در منظومه خورشیدی ما تنها این ماه است که دارای اتمسفری متراکم است.
بیش از 98% اتمسفری که تیتان (TITAN ) بزرگ ترین ماه زحل را دربر گرفته است از نیتروژن تشکیل شده است. در منظومه خورشیدی ما تنها این ماه است که دارای اتمسفری متراکم است.

 در دمای پایین نیتروژن به صورت مایع است. نیتروژن مایع در77 کلوین معادل (196- درجه سانتیگراد و 321- درجه فارنهایت ) به راحتی قابل جابه جایی است و کاربردهای زیادی دارد. نگهداری مواد در دمای پایین، در زمینه علم برودت شناسی ) علمی که در آن به عکس العمل مواد در دمای بسیار پایین می پردازد )، هم چنین به عنوان عامل سرد کننده در کامپیوتر ( مایعی که از آن استفاده می شود تا از بالا رفتن دما در کامپیوتر جلوگیری کند)، ازبین برنده زگیل نیز بوده و بسیاری چیزهای دیگر.
در دمای پایین نیتروژن به صورت مایع است. نیتروژن مایع در77 کلوین معادل (196- درجه سانتیگراد و 321- درجه فارنهایت ) به راحتی قابل جابه جایی است و کاربردهای زیادی دارد. نگهداری مواد در دمای پایین، در زمینه علم برودت شناسی ) علمی که در آن به عکس العمل مواد در دمای بسیار پایین می پردازد )، هم چنین به عنوان عامل سرد کننده در کامپیوتر ( مایعی که از آن استفاده می شود تا از بالا رفتن دما در کامپیوتر جلوگیری کند)، ازبین برنده زگیل نیز بوده و بسیاری چیزهای دیگر.
 در بیماری کم فشاری ( که به آن بندز نیز گفته می شود ) نیتروژن به صورت حباب هایی درون رگ های انتقال خون و دیگر قسمت های مهم بدن ایجاد می شود که در آن شخص به هنگام غواصی به طور ناگهانی دچار بی فشاری می شود مشابه با چیزی که فضانوردان و یا کسانی که در هواپیماهای کم فشار کار می کنند با آن رو به رو می شوند.
در بیماری کم فشاری ( که به آن بندز نیز گفته می شود ) نیتروژن به صورت حباب هایی درون رگ های انتقال خون و دیگر قسمت های مهم بدن ایجاد می شود که در آن شخص به هنگام غواصی به طور ناگهانی دچار بی فشاری می شود مشابه با چیزی که فضانوردان و یا کسانی که در هواپیماهای کم فشار کار می کنند با آن رو به رو می شوند.
 اکسید نیتروس (که به آن گاز خنده آور نیز گفته می شود با فرمول شیمیایی N2O ) در بیمارستان ها وکلینیک های دندانپزشکی به عنوان بیهوش کننده مورد استفاده قرار می گیرد . (در جراحی های مختلف به عنوان از بین برنده و کاهش دهنده درد و هوشیاری عمومی کاربرد دارد.)
اکسید نیتروس (که به آن گاز خنده آور نیز گفته می شود با فرمول شیمیایی N2O ) در بیمارستان ها وکلینیک های دندانپزشکی به عنوان بیهوش کننده مورد استفاده قرار می گیرد . (در جراحی های مختلف به عنوان از بین برنده و کاهش دهنده درد و هوشیاری عمومی کاربرد دارد.)
 اکسید نیتروس هم چنین در مسابقات موتورسواری برای افزایش قدرت موتور و سرعت وسیله نقلیه استفاده می شود که در این صورت به آن نیتروس یا NOS گفته میشود .
اکسید نیتروس هم چنین در مسابقات موتورسواری برای افزایش قدرت موتور و سرعت وسیله نقلیه استفاده می شود که در این صورت به آن نیتروس یا NOS گفته میشود .
 اکسید نیتروس یکی از گازهای گلخانه ای قابل توجه واز آلاینده های هوا است . تاثیر آن از نظر وزنی 300 برابر بیشتر از دی اکسید کربن است.
اکسید نیتروس یکی از گازهای گلخانه ای قابل توجه واز آلاینده های هوا است . تاثیر آن از نظر وزنی 300 برابر بیشتر از دی اکسید کربن است.
 نیتروگلیسرین مایعی است که در ایجاد انفجار مانند دینامیت مورد استفاده قرار می گیرد واغلب در صنایع ساخت وساز ونظامی کاربرد دارد.
نیتروگلیسرین مایعی است که در ایجاد انفجار مانند دینامیت مورد استفاده قرار می گیرد واغلب در صنایع ساخت وساز ونظامی کاربرد دارد.
 اسید نیتریک (HNO3) اسیدی قوی است که غالبا در عمل لقاح استفاده می شود.
اسید نیتریک (HNO3) اسیدی قوی است که غالبا در عمل لقاح استفاده می شود.
 آمونیا (HN3 ) یکی دیگر از ترکیبات نیتروژن است که بیش تر در عمل بارورسازی مصرف می شود.
آمونیا (HN3 ) یکی دیگر از ترکیبات نیتروژن است که بیش تر در عمل بارورسازی مصرف می شود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
حقایقی درباره کربن
کربن نقشی اساسی در دنیای ما ایفا می کند از دی اکسید کربن موجود در هوا گرفته تا گرافیت (کربن ) موجود در مداد شما، همه جا می توانید آثار آن را بیابید. در این مقاله شما می توانید درباره کاربردهای بیشتر کربن، اتم کربن، ویژگی های آن ، هیدروکربن ها، ساختار کربن، بافت کربن ، منوکسید کربن ، ردپای کربن در شما و حقایق جالب توجه دیگر اطلاع کسب کنید.
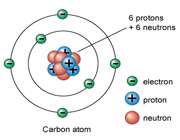
 علامت شیمیایی عنصر کربن C است و عدد اتمی آن 6 می باشد.
علامت شیمیایی عنصر کربن C است و عدد اتمی آن 6 می باشد. کربن از کلمه لاتین کربو به معنای ذغال گرفته شده است.
کربن از کلمه لاتین کربو به معنای ذغال گرفته شده است. کربن تعداد زیادی ترکیب را به وجود می آورد که از ترکیبات دیگر عناصر خیلی بیشتر است. به دلیل توانایی کربن در برقراری پیوند با دیگر عناصر غیر فلزی، اغلب از آن به عنوان ماده سازنده حیات نام می برند.
کربن تعداد زیادی ترکیب را به وجود می آورد که از ترکیبات دیگر عناصر خیلی بیشتر است. به دلیل توانایی کربن در برقراری پیوند با دیگر عناصر غیر فلزی، اغلب از آن به عنوان ماده سازنده حیات نام می برند.
 در حالی که کربن ترکیبات متفاوتی را به وجود می آورد ولی عنصری بدون واکنش است.
در حالی که کربن ترکیبات متفاوتی را به وجود می آورد ولی عنصری بدون واکنش است.
 کربن دارای شکل های متفاوتی است سه نوع آن دارای ساختمانی نامشخص است. (ذغال ، دوده و غیره )، الماس و گرافیت.
کربن دارای شکل های متفاوتی است سه نوع آن دارای ساختمانی نامشخص است. (ذغال ، دوده و غیره )، الماس و گرافیت.
 گرافیت و الماس ویژگی های بسیار متفاوتی دارند. الماس بسیار شفاف و دارای جنسی سخت است. در حالی که گرافیت بسیار نرم و سیاه است ( به اندازه ای نرم است که با آن روی کاغذ می نویسند. )
گرافیت و الماس ویژگی های بسیار متفاوتی دارند. الماس بسیار شفاف و دارای جنسی سخت است. در حالی که گرافیت بسیار نرم و سیاه است ( به اندازه ای نرم است که با آن روی کاغذ می نویسند. )

 از گرافیت به عنوان یک عایق حرارتی استفاده می شود ( گرما را به میزان کم تری منتقل می کند. ) گرافیت هم چنین یک رسانای خوب و الکتریسیته است.
از گرافیت به عنوان یک عایق حرارتی استفاده می شود ( گرما را به میزان کم تری منتقل می کند. ) گرافیت هم چنین یک رسانای خوب و الکتریسیته است.
اتم های کربن در گرافیت به شکل شش ضلعی تخت ولایه به لایه بر روی صفحه قرار گرفته است.
 از نظر فراوانی کربن چهارمین عنصر موجود در جهان است. (بعد از هیدروژن –هلیوم و اکسیژن ). در پوسته زمین پانزدهمین عنصر فراوان موجود است و در بدن انسان دومین عنصر فراوان است. (البته بعد از اکسیژن )
از نظر فراوانی کربن چهارمین عنصر موجود در جهان است. (بعد از هیدروژن –هلیوم و اکسیژن ). در پوسته زمین پانزدهمین عنصر فراوان موجود است و در بدن انسان دومین عنصر فراوان است. (البته بعد از اکسیژن )
 کربن دارای بالاترین درجه ذوب در بین دیگر عناصر است. حدود 3500 درجه سانتیگراد (3773 کلوین و 6332 درجه فارنهایت )
کربن دارای بالاترین درجه ذوب در بین دیگر عناصر است. حدود 3500 درجه سانتیگراد (3773 کلوین و 6332 درجه فارنهایت )
 هیدروکربن ها ترکیبات آلی هستند که از مولکول هایی با خصیصه های هیدروژن و کربن تشکیل شده اند.
هیدروکربن ها ترکیبات آلی هستند که از مولکول هایی با خصیصه های هیدروژن و کربن تشکیل شده اند.
 ساده ترین ترکیب هیدروکربن متان با فرمول شیمیایی ( CH4) است.
ساده ترین ترکیب هیدروکربن متان با فرمول شیمیایی ( CH4) است.
 کربن در تمدن های اولیه انسانی به صورت ذغال چوب و دوده کشف شد.
کربن در تمدن های اولیه انسانی به صورت ذغال چوب و دوده کشف شد.
 «ردپای کربن » جمله ای است که معنای آن در ارتباط با گازهای گلخانه ای منتشر شده توسط یک کشور، موسسه و یاشخص خاصی است.
«ردپای کربن » جمله ای است که معنای آن در ارتباط با گازهای گلخانه ای منتشر شده توسط یک کشور، موسسه و یاشخص خاصی است.
 چرخه کربن فرآیندی است که در آن کربن در همه جای زمین علی الخصوص در سیستم های حیاتی آن رد و بدل می شود.
چرخه کربن فرآیندی است که در آن کربن در همه جای زمین علی الخصوص در سیستم های حیاتی آن رد و بدل می شود.
این امری بسیار مهم و حیاتی روی زمین است که به کربن این امکان را می دهد که پیوسته در حال بازیافت و یا استفاده مجدد باشد.
 |
 دراتمسفر زمین، کربن به صورت دی اکسید کربن (CO2 ) یافت می شود. اگرچه حجم کمی از اتمسفر را اشغال می کند، ولی نقشی اساسی در این باره دارد. از جمله این که توسط گیاهان در زمان فتوسنتز مورد استفاده قرار می گیرد.
دراتمسفر زمین، کربن به صورت دی اکسید کربن (CO2 ) یافت می شود. اگرچه حجم کمی از اتمسفر را اشغال می کند، ولی نقشی اساسی در این باره دارد. از جمله این که توسط گیاهان در زمان فتوسنتز مورد استفاده قرار می گیرد.
 منوکسید کربن (CO ) برای انسان و حیوان بسیار سمی است و در شرایطی که اکسیژن به اندازه کافی برای شکل گیری دی اکسید کربن نیست منوکسید شکل می گیرد. در بسیاری از کشورهای سراسر دنیا مسمومیت با منوکسید کربن یکی از متداول ترین و کشنده ترین مسمومیت هاست.
منوکسید کربن (CO ) برای انسان و حیوان بسیار سمی است و در شرایطی که اکسیژن به اندازه کافی برای شکل گیری دی اکسید کربن نیست منوکسید شکل می گیرد. در بسیاری از کشورهای سراسر دنیا مسمومیت با منوکسید کربن یکی از متداول ترین و کشنده ترین مسمومیت هاست.
 بافت کربن ماده ای بسیار سخت است که از بافت های نازک که عمدتاٌ از اتم های کربن که به صورت کریستال های میکروسکوپی به هم پیوند شده اند و در مواردی که استقامت بالا و وزن کم مورد نیاز است مورد استفاده قرار می گیرد.
بافت کربن ماده ای بسیار سخت است که از بافت های نازک که عمدتاٌ از اتم های کربن که به صورت کریستال های میکروسکوپی به هم پیوند شده اند و در مواردی که استقامت بالا و وزن کم مورد نیاز است مورد استفاده قرار می گیرد.
 سوخت های فسیلی مانند گاز متان ویا نفت خام ( بنزین ) نقش مهمی در اقتصاد مدرن ایفا می کند.
سوخت های فسیلی مانند گاز متان ویا نفت خام ( بنزین ) نقش مهمی در اقتصاد مدرن ایفا می کند.
 پلاستیک از مشتقات پلی مرهای کربن به وجود می آید. کربن به عنوان یک آلیاژ با آهن ترکیب می شود مثل استیل کربن.
پلاستیک از مشتقات پلی مرهای کربن به وجود می آید. کربن به عنوان یک آلیاژ با آهن ترکیب می شود مثل استیل کربن.
 گرافیت و خاک رس برای ساخت مغز مداد استفاده می شود.
گرافیت و خاک رس برای ساخت مغز مداد استفاده می شود.
 ذغال چوب اکثراٌ برای کباب کردن غذا در منقل استفاده می شود.
ذغال چوب اکثراٌ برای کباب کردن غذا در منقل استفاده می شود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
انواع اوربیتال هیبریدی
اوربیتال هیبریدی SP

درگیر شدن تمام اوربیتال های پوسته والانس اتم مرکزی یک مولکول، در تشکیل اوربیتال های هیبریدی ضرورت ندارد. تنها آن تعداد از اوربیتال های مزبور برای تشکیل اوربیتال های هیبریدی مورد استفاده قرار میگیرند که تعداد پیوند لازم و نیز شکل هندسی مولکول را تأمین کنند. برای مثال توابع موجی سه اوربیتال هیبرید را میتوان از ترکیب ریاضی توابع موجی یک اوربیتال S و دو اوربیتال P به دست آورد. یکی از سه اوربیتال P، در این عمل شرکت نمیکند.
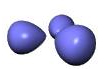
اوربیتال هیبریدی SP3
هیبریداسیونSP3 یک نوع مهم و متداول میباشد. این اوربیتالها از هیبرید شدن یک اوربیتال S و 3 اوربیتال P تشکیل میشوند.

اوربیتال هیبریدی SP3 با یک جفت الکترون غیر پیوندی: در مولکولهایی مانند NH3 میتوان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آن ها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریباً به صورت یک 4 وجهی است و زاویه پیوند تقریبا برابر با 107 درجه میباشد.
اوربیتال هیبریدی SP3 با دو جفت الکترون غیر پیوندی: اتم اکسیژن هم در مولکول H2O از اوربیتالهای SP3 استفاده میکند که در آن دو اوربیتال هیبریدی توسط دو جفت الکترون غیر مشترک اشغال شدهاند. زوایای اتم و 104/5 0 میباشد که این زاویه به 1090 نزدیک تر است تا به 900 ، که در صورت به کار رفتن اوربیتال خالصP، انتظار میرفت.
اوربیتال هیبریدی دارای اوربیتال d
اوربیتالهای d2SP3 : این اوربیتالها از هیبرید شدن 2 اوربیتال d و یک اوربیتال s و 3 اوربیتال p به وجود میآیند.
هر 6 اوربیتال با یکدیگر همارز بوده و به سوی گوشههای یک هشت وجهی منتظم جهت گیری دارند. یک نوع از این ها با یک جفت الکترون غیر پیوندی (این اوربیتال دارای شکل هرم، با قاعده مربع) بوده و نوع دیگرش با دو جفت الکترون غیر پیوندی (این اوربیتال دارای شکل مربع مسطح) میباشد.

اوربیتال اتمی dx2 - y2: در تشکیل این اوربیتال هیبریدی دخالتی ندارد. پنج اوربیتال حاصل با یکدیگر همارز نیستند. این اوربیتالها در گوشههای یک دو هرمی مثلثی جای میگیرند. زاویه بین پیوندهایی که در قاعده قرار گرفتهاند 1200 و پیوندهای خارج از قاعده 900 و زاویهای که دو راس هرم را به هم وصل میکند 1800 میباشد.

نکات مهم در هیبریداسیون اوربیتالها
• محاسبات نشان میدهد که استفاده از اوربیتالهای هیبریدی به تشکیل پیوندهای قوی تر منجر میشود.
• انرژی لازم برای ایجاد حالت برانگیخته و هم چنین انرژی لازم برای هیبرید شدن، بیش تر از انرژی آزاد شده به هنگام تشکیل دو پیوند نسبتا قوی کوالانسی است.
• اوربیتالهایی که در آن ها دو نوع معینی از هیبریداسیون به کار رفته است، باید از لحاظ انرژی نسبتا به هم نزدیک باشند.
• اوربیتالهایی که معمولاً در تشکیل پیوند به کار میروند اوربیتالهای d , p , s لایه خارجی و در برخی موارد اوربیتال d لایه ماقبل لایه خارجی هستند. به استثنای این اوربیتالهای d داخلی، الکترونهای اوربیتالهای داخلی معمولاً آن قدر به هسته وابسته هستند که نمیتوانند در تشکیل پیوند شرکت کنند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
چرخه شناسایی آب
در اتمسفر زمین سیستم گردش آب به طور پیوسته وجود دارد. در درون این چرخه، جریان آب از سمت زمین به سوی اتمسفر و مجددا با برگشت به سوی زمین صورت می گیرد.
 |
اگرچه مراحل زیادی در شکل گیری این چرخه وجود دارند ولی مهم ترین آن ها به شرح ذیل می باشند.
- تبخیر
- فراتراوش
- میعان
- بارش
- جاری شدن
تبخیر
به تغییر فرم ماده، از حالت مایع به حالت گاز تبخیر می گوییم. در علم هواشناسی ماده مورد نظر آب می باشد. برای این که تبخیری صورت بگیرد نیازمند مقداری انرژی هستیم.
این انرژی را از منابع متعددی مثل خورشید، اتمسفر، زمین و یا موجودات روی زمین مانند انسان می توان گرفت. همه ما تجربه هایی پیرامون موضوع تبخیر داریم . هنگامی که دمای بدن ما در اثر گرمای هوا و یا ورزش کردن بالا می رود بدن عرق کرده و آب روی پوست ظاهر می شود.
این اتفاق به این دلیل می افتد که بدن از گرمای درون خودش برای تبخیر مایع استفاده می کند و به این ترتیب گرما از بین رفته و بدن سرد می شود. هم چنین هنگامی که شما از زیر دوش یا استخر بیرون می آیید همان تاثیر را می بینید. احساس خنکی شما به دلیل رفع گرمای بدن برای ایجاد بخار آب روی پوست (عرق) است.
فراتراوش (بخار کردن )
به تبخیر آب از طریق منافد گیاهان عمل (فراتراوش – تنفس ) گفته می شود. منافذ به دریچه های ریزی گفته می شود که در زیر برگ وجود دارد و به بافت آوندی گیاه متصل شده اند. در اکثر گیاهان، عمل فراتراوش طی مراحلی که اغلب توسط رطوبت اتمسفر و نم موجود در خاک کنترل می شود، صورت می گیرد. فقط یک درصد از آبی که از طریق ریشه وارد گیاه می شود، جهت مراحل رشد مورد استفاده گیاه قرار می گیرد. مابقی آن که 99 درصد می باشد وارد اتمسفر می شود.
میعان
در عمل میعان، بخار آبی که در اتمسفر وجود دارد تبدیل به مایع می شود. در اتمسفر میعان به شکل ابر و یا شبنم مشاهده می شود. وقتی که آب بر دیواره قوطی ویا بطری نوشابه ای که بدون درپوش است می نشیند در اصطلاح می گوییم میعان رخ داده است.
میعان در یک دمای خاص اتفاق نمی افتد بلکه معمولا در اختلاف بین دو دما شکل می گیرد. مانند تفاوتی که بین دمای هوا و نقطه شبنم وجود دارد. در یک بیان ساده نقطه شبنم به دمایی که شبنم در آن شکل می گیرد گفته می شود. در واقع دما نقش مهمی در این مورد ایفا می کند به این صورت که اگر هوا به سطح مشخصی از سرما برسد اشباع می شود. هر نوع افزایش در آن دما باعث تبدیل بخار آب به مایع می شود.
اغلب هنگامی که دمای هوا و دمای نقطه تشکیل شبنم برابر شود مه تشکیل می شود. میعان نقطه مقابل تبخیر است. از آنجایی که بخار آب نسبت به آب، در حالت مایع، از سطح انرژی بالاتری برخوردار است، هنگامی که میعان صورت می گیرد، انرژی اضافی به شکل انرژی گرمایی آزاد می شود. این آزاد سازی گرما در شکل گیری گردباد نقش دارد.
بارش
هنگامی که قطرات کوچک در میعان به هم می پیوندند، و به قطرات بزرگ تری تبدیل می شوند، قطرات باران ایجاد می شود که با افزایش تراکم قطرات بارش، به سمت زمین فرو می ریزد.
بارش به صورت های مختلف مثل باران، تگرک، برف و یا باران دیده می شود.
بارش یکی از ساده ترین راه ها برای دریافت آب تازه در زمین است. به طور میانگین خشکی ها و دریاهای کره زمین سالانه حدود 5/38 اینچ (980 میلی لیتر ) آب از طریق بارندگی دریافت می کنند.
جاری شدن آب
وقتی بارش ها از حد ظرفیت زمین بیش تر شوند و زمین اشباع گردد،( یعنی دیگر آب را به خود جذب نکند )، عمل جاری شدن آب اتفاق می افتد. رودخانه ها ودریاچه ها در اثر این جریان آب به وجود می آیند. در حرکت آب به سوی رودخانه ها و دریاچه ها مقداری عمل تبخیر هم صورت می گیرد ولی بیشتر آب به اقیانوس ها برمی گردد.
اگر آب به گونه ای باشد که فقط وارد دریاچه شود و دریاچه خروجی نداشته باشد تا آب از آن خارج شود، تنها راه بازگشت آب به اتمسفر تبخیر آن است. با عمل تبخیر، تنها آب خالص بخار می شود و بنابراین هر گونه آلودگی و نمک برجای خواهد ماند ودر نهایت دریاچه نمکی خواهیم داشت.
در تبخیر آب به سوی اتمسفر ، جریان آب دوباره برقرار می شود. قسمتی از آب به درون خاک و زمین نفوذ می کند تا دوباره توسط گیاهان جذب شده و عمل پس دادن بخار (فرا تراوش ) صورت بگیرد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تولید مثل

همه ی جاندارانی كه پیرامون ما هستند یا تك سلولی و یا پر سلولی هستند هر یك از این جانداران توانایی دارند كه هم نوع خود را به وجود آورند. به عبارت دیگر تولید مثل كنند.
اهمیت تولید مثل:

همه ی موجودات زنده برای بقای خود فعالیت هایی مانند: تنفس كردن، رشد كردن، .... انجام می دهند. اما یكی از مهم ترین كارهای موجودات زنده فعالیت در جهت بقای نسل خود است.
اگر جانداری نتواند فعالیت غیر تولید مثل انجام دهد از بین می رود اما اگر این گونه از جانداران نتوانند فعالیت تولید مثل انجام دهد نسل جاندار منقرض خواهد شد. بقای نسل در جاندار به عوامل ارثی محیطی جاندار مربوط می شود.
توانایی مقاومت یك جاندار در برابر بیماری ها، شكار شدن، عوامل محیطی، آب و هوا، تغییرات دما، بلایای طبیعی مانند زلزله، سیل، آتشفشان از جمله عوامل محیطی و ارثی هستند.

در تولید مثل غیر جنسی، جاندار به مرحله ای از رشد خود كه می رسد می تواند تكثیر شود و افراد جدیدی را به وجود آورد. بسیاری از جانداران ساده كه ساختمان بدنی ساده ای دارند و برخی گیاهان به این روش زیاد می شوند مانند: باكتری ها، تك سلولی ها، برخی گیاهان و جانداران.
در روش تولید مثل غیر جنسی همه ی جانداران تكثیر یافته یك گونه و كاملا مانند هم بوده و خصوصیات ساختمانی و حیاتی یكسانی دارند. در این جانداران اگر شرایط محیطی تغییر كند و این شرایط برای جاندار مضر باشد همه ی نسل آن ها از بین می رود.

دونیم شدن:
در این روش یك جاندار مانند: آسیب تقسیم می شود و به جاندار كه از نظر اندازه تقریبا ساده است تبدیل می شود.
جوانه زدن:
بعضی از جانداران مانند هیدر به این روش زیاد می شوند در این روش برآمدگی كوچكی در بدن جاندار ایجاد می شود و كم كم به جانداری مستقل تبدیل شده و ممكن است از بدن جاندار اولیه جدا شود یا هم چنان متصل باقی بماند مانند: هیدر آب شیرین و مخمرنان.
قطعه قطعه شدن:
در این روش، بدن جاندار به چندین قطعه تقسیم می شود. سپس بعضی، یا همه ی آن ها به جاندار بالغ تبدیل می شوند. مثلا جلبك اسپیروژیر با این روش زیاد می شود. این گیاهان نیز با روش تولید مثل غیرجنسی زیاد می شوند.
تولید مثل رویشی در گیاهان به دو طریق طبیعی و مصنوعی صورت می گیرد.

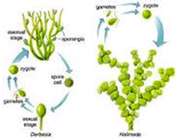
ساقه زیر زمینی:
بعضی از گیاهان با ساقه زیر زمینی زیاد می شوند،ساقه های زیر زمینی كلروفیل ندارند و دارای برگ های قهوه ای فلس مانند دارند.

ریزم:
ریزم تقریبا به صورت افقی در خاك رشد می كند در انتهای این ساقه ها جوانه انتهای وجود دارد، مانند مهد سلیمان.
غده:
غده به منزله ی انتهای ساقه است كه دارای اندوخته غذایی است مانند سیب زمینی.
پیاز:
در پیاز تعدادی برگ بدون سبزینه وجود دارد كه اطراف جوانه قرار دارد. (مانند پیاز خوراكی) سنبل.

بنه:
بنه نسبت به پیاز ساقه بزرگ تری دارد اما فاقد فلس های متعدد است، مانند: زعفران و گلایل.
هاگزایی:
در این روش تولید مثل هاگ به وجود می آید هاگ یك سلول ویژه است كه توسط جاندار اولیه تولید می شود. و به تنهایی و به طور مستقیم جاندار به وجود می آورد. مثلا در كپك نان هاگ ها در اندام هایی به نام هاگدان تولید می شود. پس از رسیدن هاگ در هاگدان، هاگدان پاره می شود و هاگ ها همراه باد و آب به نقاط مختلف می روند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تولید مثل ( 2)
در مقاله ی گذشته مطالبی در رابطه با تولید مثل دانستیم. در این ادامه خواهیم دانست...
تولید مثل جنسی:
در این روش تولید مثل، باید دو نوع سلول جنسی نر و ماده وجود داشته باشد. این سلول ها با هم تركیب شده و اولین سلول جاندار جدید كه سلول تخم نام دارد به وجود می آید.
بنابر این در روش تولید مثل جنسی، گامت نر (سلول جنسی نر) و گامت ماده (سلول جنسی ماده) در اندام های تولید مثل نر و ماده تولید می شود و از تركیب آن ها سلول تخم به وجود آید. به تركیب شدن سلول نر و ماده لقاح می گویند.
تولید مثل جنسی در گیاهان گل دار:
بیشتر گیاهان با كاشتن دانه زیاد می شوند و دانه ها توسط گل ها تشكیل می شوند.
گل اندام تولید مثلی در گیاهان گل دار است. در گیاهان پیدایش گل موجب آغاز دوره ی جدید (تولید مثل جنسی گیاه) است. نقش گل، تشكیل گامت ها و فراهم كردن شرایط تركیب آن ها با یكدیگر است.
بعضی از گل ها ممكن است یك یا چند بخش دانه داشته باشند كه به آن ها گل ناقص می گویند.
 هنگامی كه دانه گرده در درون بساك پرچم كامل می شود كیسه بساك پاره شده و دانه ها پراكنده می شوند و توسط عوامل مختلف مانند باد، حشرات و ... پراكنده می شوند.
هنگامی كه دانه گرده در درون بساك پرچم كامل می شود كیسه بساك پاره شده و دانه ها پراكنده می شوند و توسط عوامل مختلف مانند باد، حشرات و ... پراكنده می شوند.

چنان چه دانه ی گرده ی یك گل، روی كلاله مادگی همان گل بیفتد، گردافشانی را مستقیم، و چنان چه دانه گرده ای روی كلاله مادگی گل دیگر از همان نوع قرار گیرد گرده افشانی را غیر مستقیم می گویند.
در درون دانه ی گرده دو نوع هسته رویشی و زایشی وجود دارد. از تقسیم شدن هسته زایشی سلول جنسی نر (گامت نر) به وجود می آید.
گامت نر با گامت ماده ی موجود در تخمدان تركیب می شود و سلول تخم به وجود می آید. سلول تخم، درون تخمك قرار دارد تبدیل به دانه و تخمدان تبدیل به میوه می شود.
بنابر این میوه، تخمدان رشد كرده و رسیده ی گل است كه ممكن است قسمت های دیگر گل را نیز به همراه داشته باشد. میوه ی موجب حفاظت از دانه و موجب پراكندگی و زمانبندی لازم برای رویش دانه می شود.
تولید مثل جنسی در جانوران:
در جانداران نیز مانند گیاهان سلول جنسی نر (اسپرم) در اندام تولید مثلی نر (بیضه) و سلول جنسی ماده تخمك در اندام تولید مثلی ماده به وجود می آید. در همه ی مهره داران و بعضی از بی مهره ها اندام تولید مثلی نر و ماده در دو جاندار جدا از هم وجود دارد، اما مانند اسفنج ها، مرجان ها، بعضی كرم ها، نرم تنان.
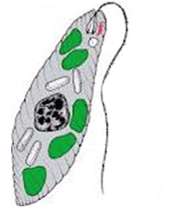
در بعضی از جانداران ساده تر:
روش تولید مثل جنسی در جانداران متفاوت است اما دو ویژگی مشترك در این روش ها وجود دارد.
(كامت نر و ماده باید با هم برخورد كنند و تركیب شوند و سلول تخم به وجود آید.)


تولید مثل در انسان:
تولید مثل در انسان نیز مانند سایر پستانداران با تشكیل سلول جنینی نر (اسپرم) بیضه و سلول جنسی ماده یا تخمك در تخمدان و تركیب هسته های آن ها با یكدیگر و ایجاد سلول تخم صورت می گیرد.
غدد جنسی در مردان بیضه و در زنان تخمدان نام دارد. وظایف غدد جنسی تولید گامت و هورمون های جنسی است.
بیضه:
بیضه ها شامل یك جفت غده هستند كه در زیر شكم و درون كیسه بیضه قرار دارند. این غدد شامل لوله های نازك و پرپیچ و خمی هستند كه به لوله های اسپرم ساز موسومند. این لوله ها عمل اسپرم سازی از دوران بلوغ شروع می كنند و تا پایان عمر ادامه می دهند.
تخمدان ها شامل دو عدد غده ی بیضی شكل است كه در دو طرف داخل شكم، در پایین و جلوی روده ها قرار دارند تخمدان ها، تخمك سازی را ازدوران بلوغ شروع كرده و تا حدود 30 الی 40 سالگی ادامه می دهند.
معمولا هر ماه یك تخمك نارس فعال می شود و به یك تخمك كامل تبدیل می شود این سلول به و سیله ی لوله های فالوب به دورن رحم انتقال می یابد و چنان چه با سلول نر یا اسپرم تركیب شود به سلول تخم تبدیل می شود تخم با تقسیمات خود جنین را به وجود می آورد كه از طریق جفت با خون مادر ارتباط غذایی پیدا می كنند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
یادگیری

همان گونه که مستحضرید اهمیت علم روان شناسی درکشورمان به صورت مدرن آن در چند دهه ی اخیر، بیش از پیش آشکار شده است.
به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
برای یادگیری تعاریف متفاوتی بیان شده است. مثلا: یادگیری یعنی تغییر نسبتا دایمی رفتار که در اثر تجربه حاصل می شود.
بنابر این تعریف تغییرات رفتار در اثر رشد یا تغییرات فیزیولوژیک یادگیری محسوب نمی شوند، فرضا وقتی کودک به یک سالگی می رسد، تغییراتی از نظر قد و وزن پیدا می کند یا وقتی در تاریکی قرار می گیریم تغییراتی در دستگاه بینایی ما به وجود می آید، اما هیچ یک از این دو، یادگیری به حساب نمی آید.

غیر از بازتاب های طبیعی، تقریبا همه رفتارهای انسان تحت تأثیر یادگیری است، اما در مورد حیوانات این طورنیست، رفتار حیوانات تا اندازه ی زیادی غریزی یا ذاتی ست.
ماهی ها وقتی به دنیا می آیند شناکردن می دانند. سارها به طور غریزی می دانند که چگونه آواز بخوانند و چگونه لانه درست کنند. اما تنوع و پیچیدگی رفتار انسان اصولا نتیجه یادگیری از راه تجربه است.
تجربه برای یادگیری راه رفتن، حرف زدن به زبان مادری و محیط، جنبه بنیادی دارد. ما خواندن، محاسبه کردن، و استفاده ی سمبلیک ازتصاویر هندسی را می آموزیم. یاد می گیریم که وقتی گرسنه هستیم به دنبال غذایی برویم که در فرهنگ ما پذیرفته شده است. نوع غذایی را که انتخاب می کنیم، به ارث نبرده ایم، بلکه به مرور یاد گرفته ایم. رفتار هایی که از نظر اجتماع قابل پذیرش یا غیر قابل پذیریش هستند، یاد می گیریم.
یکی از جنبه های یادگیری، شرطی شدن است.
شرطی شدن یعنی بین دو رویداد ارتباط برقرار کردن، به نحوی که وقتی یکی ظاهر شد، دیگری نیز ظاهر شود. برای نمونه مسلما در رانندگی دیدن چراغ قرمز می ایستیم نه چراغ سبز.
این دانش را که با دیدن چراغ قرمز توقف کنیم، بدو تولد نداشتیم. در واقع ما معنای این علایم را یاد گرفته ایم. چون آن ها با سایر رویداد همراه شده اند، یعنی رعایت قانون ترمز با قرمز شدن چراغ باعث جلوگیری از تصادفات رانندگی و جریمه شدن، شده است، ما آن را انجام می دهیم.
ایوان پاولف فیزیولوژیست روسی اولین کسی بود که این نوع یادگیری، یعنی ایجاد پیوند بین رویداد ها را مورد مطالعه قرار داد.
او در جریان تحقیقات خود روی سگ ها کشف کرد که حیوانات نیز می توانند بین رویداد ها ارتباط برقرار کنند. در آزمایشات پاولف وقتی گوشت در دهان سگ قرار می گرفت، حیوان بر اساس ساخت زیستی خود، بزاق تراوش می کرد. ترشح بزاق در برابر گوشت، یک پاسخ طبیعی یا غیر اکتسابی یا غیر شرطی است که بازتاب نامیده می شود.
در این جا گوشت محرک نامیده می شود، یعنی عاملی که موجب واکنش ارگانیسم می گردد.
پاولف نشان داد که بازتاب ها نیز در اثر ارتباط، آموخته یا شرطی می شوند. مثلا صدای سینی غذا، حتی صدای پای دستیار آزمایشگاه، باعث ترشح بزاق حیوان می شد. در واقع یاد گرفته بود.
پاولف این نوع پاسخ های بزاقی را بازتاب های شرطی نامید. این بازتاب ها به شرطی ایجاد می شوند که محرک خنثی مثلا در اینجا، صدای سینی غذا و محرک غیر خنثی که در این جا خود غذاست، _و به طور طبیعی پاسخ ترشح بزاق را ایجاد می کند_ بار ها با یکدیگر همراه شوند.
امروزه بازتاب های شرطی را معمولا پاسخ های شرطی می نامند. بنابراین پاسخ شرطی، آموخته می شوند.
پاولف آزمایش خود را با کمی تفاوت چند بار تکرار کرد. بدین ترتیب که مدت کوتاهی پیش از دادن غذا به حیوان، زنگی را به صدا در آورد. پس از چند بار تکرار، سگ در مقابل صدای زنگ نیز براق ترشح می کرد، چون بین صدای زنگ و به دنبال آن، غذا ارتباط برقرار کرده بود. و در واقع شرطی شده بود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 1
هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.
اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند،باحروف یونانی (سیگما) و
(سیگما) و  (پی) نمایش میدهند.
(پی) نمایش میدهند.
هنگام تشکیل یک پیوند، دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی، نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
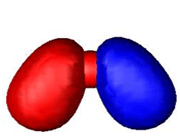
اوربیتال پیوندی
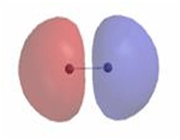
اوربیتال ضد پیوندی
با توجه به نارسایی های نظریه پیوند ظرفیت، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی، ترازهای انرژی، خواص طیفی و ... را به روشنی میتوان توجیه کرد.
در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) تمام اوربیتال های اتم میتواند در تشکیل اوربیتال های مولکولی شرکت داشته باشد و این اوربیتال ها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
علاوه بر اوربیتال های پیوندی و غیر پیوندی، اوربیتال های ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتال های اتمی شرکت کننده، اوربیتال های مولکول تشکیل میشود.
شرایط همپوشانی اوربیتال ها
برای اینکه اوربیتال های اتمی بتوانند در حد تشکیل پیوند با یکدیگر همپوشانی کنند، باید دو شرط زیر درباره آن ها برقرار باشد:
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که، دریک سطح انرژی قرار داشته و یا سطوح انرژی آن ها به اندازه کافی به یکدیگر نزدیک باشد.
مثلا اوربیتال 3P یک اتم کلر می تواند فقط با اوربیتال 3P اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال 1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از این رو، مثلاً اوربیتال S که تقارن کروی دارد، در تشکیل مولکول های خطی میتواند با اوربیتال 2P که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.
انواع اوربیتال های مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی پیوندی اوربیتال مولکولی است که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند، کمتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی ضد پیوندی اوربیتال مولکولی است که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند، بیشتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
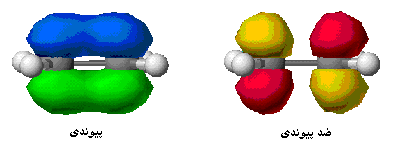
هر گاه دو اتم نتوانند به طریقی به هم نزدیک شوند که امکان همپوشانی اوربیتال های آن ها به وجود آید، همپوشانی اوربیتال ها صورت نمیگیرد و در نتیجه اوربیتال های اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتال های مولکولی را نیز با حروف یونانی  (سیگما) ،
(سیگما) ،  (پی) و ... نشانه گذاری میکنند.
(پی) و ... نشانه گذاری میکنند.
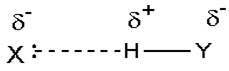
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 2
اوربیتال های مولکولی سیگما
اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از محورها مثلاً x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا 1S) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتال های سیگما، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
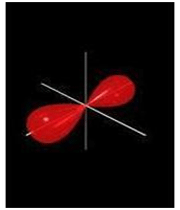
نمودار تراز انرژی تشکیل اوربیتال های مولکولی 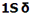 و
و  از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن، دو الکترون (با اسپین های جفت شده) اوربیتال  را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای 
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال  اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
برای H2 داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال 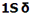 دو الکترون دیگر ناگزیر
دو الکترون دیگر ناگزیر 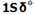 را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
0=(2-2)1/2=مرتبه پیوند
لذا هلیوم به صورت مولکولی He2 نمیتواند وجود داشته باشد. اثر جدا کننده الکترون های ضد پیوندی، اثر اتصال دهنده الکترون های پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یون های مولکولی+ H2 و + He2 می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال 2S ، اوربیتال های مولکولی و 2*S خ´ را بوجود میآورند که با اوربیتال های 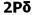 و
و 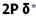 ناشی از ترکیب دو اوربیتال 1S مشابهند.
ناشی از ترکیب دو اوربیتال 1S مشابهند.

اما اوربیتال های مولکولی حاصل از ترکیب اوربیتال های اتمی 2P کمی پیچیدهترند. سه اوربیتال 2P هر اتم، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی ( و یا ) صورت گیرد، در نتیجه همپوشانی، دو اوربیتال مولکولی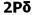 و
و 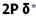 را بوجود میآورند .
را بوجود میآورند .
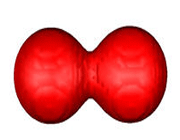
اوربیتال های مولکولی پی
اگر در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (مثلا PZ) از پهلو بهم نزدیک شوند، دو اوربیتال مولکولی، یکی اوربیتال مولکولی پیوندی پی و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره را بوجود میآورند.

اوربیتال های پای نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو، به تشکیل اوربیتال پای میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال پای ، بهم نگهداشتن مولکول است. اوربیتال پای ستاره ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی مولکول پای ستاره جدا کردن دو اتم از یکدیگر است.
سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانی اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب، انرژی هر دو اوربیتال مولکولی 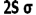 و
و 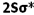 پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های
پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های 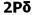 و
و 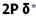 پایین تر از انرژی هر یک از دو اوربیتال
پایین تر از انرژی هر یک از دو اوربیتال 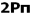 می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
در مولکولهایی که اوربیتالهای مولکولی 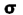 از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند
از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند 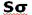 به ازای تضعیف پیوند
به ازای تضعیف پیوند 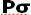 ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال
، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال 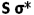 و افزایش انرژی
و افزایش انرژی 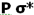 میشود. بنابراین سطح انرژی
میشود. بنابراین سطح انرژی 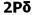 برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی
برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی 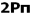 میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
الکترونگاتیویته 1
الکترونگاتیویته میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی به سوی خود است.
مقیاس نسبی پاولینگ
مقیاس نسبی الکترونگاتیوی پاولینگ، متداول ترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی 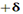 و
و 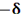 اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق
اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق 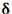 و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پائولینگ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژی های پیوند است. مثلا انرژی پیوند Br-Br ،انرژی لازم برای تفکیک مولکول Br2 به اتم های Br است. برای تفکیک یک مول از مولکول های Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.

الکترونگاتیویته به روش های متفاوتی تعریف شده است که برخی از آن ها به اختصار توضیح داده می شود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B می تواندبه حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B به طور قابل ملاحطه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد - روکر
در این تعریف الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس می کند. بر طبق این تعریف عناصری با الکترونگاتیویته بالا آن هایی هستند با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توریع دوباره الکترون در طی تشکیل ترکیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
طیف هیدروژن
از طرف دیگر
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی می کند.
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و هم چنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد.
فلزات، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آن ها حاکم است، ولی نا فلزات، به استثنای گازهای نجیب، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آن ها زیاد است.
بنابراین، الکترونگاتیوترین عناصر، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی هم جهت است
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
الکترونگاتیویته 2
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است ولی دقیق نیست. روشی ساده و مستقیم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روش های گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتم های متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم متغیر است. انتظار می رود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از این رو این مفهوم را تنها بایستی نیمه کمی تلقی کرد.
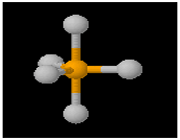
PCl5

PCl3
بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی می شود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آن ها خیلی زیاد نباشد. در این گونه موارد اختلاف الکترونگاتیوی عناصر، نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که (HF) قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل می شود (پیوند فلزی) و در آن اختلاف الکترونگاتیوی نسبتا کم است.
مقدار الکترونگاتیوی HF
کاربردهای الکترو نگاتیویته
هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 7/1 باشد. خصلت یونی نسبی پیوند بیش از 50% است.
3. اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
4. با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر 1/2 است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند پای
اوربیتالهای مولکولی حاصل از ترکیب اوربیتالهای اتمی (2P)، کمی پیچیدهاند. سه اوربیتال (2P) هر اتم، در امتداد محورهای مختصات دکارتی (X ، Y ، Z ) قرار دارند. اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از این محورها مثلاً (X) در نظر بگیریم، دو اوربیتال اتمی (Px) سر به سر به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی 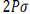 و ضد پیوندی
و ضد پیوندی 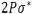 را به وجود میآورند.
را به وجود میآورند.
تعریف پیوند پی
پیوند کووالانسی که تراکم الکترونی آن در دو ناحیه بالا و پایین محور متصل کننده دو اتم پیوند بیشتر است، پیوند پی ( 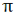 ) نامیده میشود.
) نامیده میشود.
اوربیتال پیوندی مولکولی پی ( 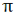 ) و ضد پیوندی (
) و ضد پیوندی ( 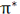 )
)
در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (Pz) از پهلو به هم نزدیک میشوند و دو اوربیتال مولکولی، یکی اوربیتال پیوندی پی ( 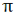 ) و دیگری اوربیتال مولکولی ضد پیوندی
) و دیگری اوربیتال مولکولی ضد پیوندی  را به وجود میآورند.
را به وجود میآورند.
اوربیتالهای 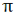 نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال
نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال  میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
در هر حال اثر نهایی اوربیتال  ، به هم نگه داشتن مولکول است. اوربیتال
، به هم نگه داشتن مولکول است. اوربیتال  ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال
، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال  جدا کردن دو اتم از یکدیگر است.
جدا کردن دو اتم از یکدیگر است.
اوربیتالهای اتمی (Py) نیز از پهلو به هم نزدیک میشوند. این دو اوربیتال اتمی نیز یک مجموعه ی دوتایی اوربیتال مولکولی  و
و 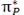 به وجود میآورند که نسبت به مجموعه اول عمود است.
به وجود میآورند که نسبت به مجموعه اول عمود است.
انرژی اوربیتالهای 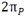 و
و 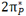
دو اوربیتال 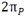 با یکدیگر و دو اوربیتال
با یکدیگر و دو اوربیتال 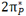 با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال
با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال 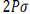 ، یک اوربیتال
، یک اوربیتال 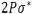 ، دو اوربیتال
، دو اوربیتال 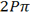 و دو اوربیتال
و دو اوربیتال  .
.
این شش اوربیتال به همراه دو اوربیتال از دو اوربیتال اتمی 2S ، مجموعا هشت اوربیتال مولکولی را تشکیل میدهند که از اوربیتالهای اتمی n=2 مربوط به دو اتم به دست میآیند.
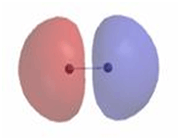
تعریف انرژی اوربیتال مولکولی
انرژی یک اوربیتال مولکولی به موارد زیر بستگی دارد:
1. انرژی اوربیتالهای اتمی تشکیل دهنده آن
2. میزان و نوع همپوشانی اوربیتالهای اتمی در هنگام تشکیل آن
مقایسه انرژی 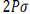 و
و 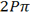
چون میزان همپوشانی اوربیتالهای 2P در تشکیل اوربیتال مولکولی 2P6 بیشتر از همپوشانی آن ها برای به وجود آوردن اوربیتال مولکولی 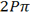 است، اوربیتال
است، اوربیتال 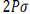 انرژی کمتری از دو اوربیتال مولکولی هم تراز
انرژی کمتری از دو اوربیتال مولکولی هم تراز  دارد.
دارد.
اوربیتالهای ضد پیوندی از هر نوع، همان قدر انرژی سیستم را افزایش می دهد که اوربیتال پیوندی از همان نوع، از انرژی سیستم میکاهد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اختلال های رفتاری

به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
جای تردید نیست که هر دستگاهی ممکن است اختلال کند، مثل هواپیما، کامپیوتر و... و بالطبع لازم می شود که دوباره تعمیر شوند. دستگاه عصبی مرکزی (مخ، نخاع و اعصاب) نیز اختلال پیدا می کند و این اختلال د رفتار منعکس می شود.
حال این اختلال رفتاری یا نابهنجاری رفتاری چیست؟
همانند بیش تر مفاهیم مربوط به انسان و مفاهیم مربوط به روان شناسی، تعریف رفتار نابهنجار و تعیین مرز آن با رفتار بهنجار، کاری بسیار دشوار و شاید هم غیر ممکن است. از نظر روان شناسان انسان بهنجار فردی است که:

بنابراین تعریف، هر فردی، کم و بیش بیمار (کم و بیش نابهنجار) خواهد بود. اما در واقع کسی که به شدت نابهنجار باشد، به طوری که نظم زندگی خود و دیگران را به هم بزند، مبادرت به خودکشی کند و همیشه اضطراب داشته باشد، فرد نابهنجار یا بیمار به حساب خواهد آمد.
اما اگر کسی به شغل شرافتمندانه ای اشتغال داشته باشد، به فکر سعادت خود و خانواده اش باشد و به حقوق دیگران احترام بگذارد و هدف اجتماع پسندی را دنبال کند، اضطراب، نگرانی، افسردگی یا شادی او متناسب با موقعیت باشد، بهنجار یا سالم به حساب خواهد آمد.
اختلال های اضطرابی
اختلال های اضطرابی نشانه های ذهنی و جسمی دارند.
در میان نشانه های ذهنی می توان به ترس از بدبختی، ترس از کنترل نداشتن بر خود، ناتوانی در راحت بودن و رفع خستگی اشاره کرد.
نشانه ی جسمی اضطراب عبارت است: از فعالیت شدید شاخه ی سمپاتیک دستگاه عصبی خودکار که با لرزش، عرق، سرعت و شدت تپش های قلبی، بالا رفتن فشار خون (سرخ شدن چهره) و سرگیجه همراه است.
می توان گفت که اضطراب، یک واکنش مناسب در مقابل تهدید است. با این همه، اگر گستردگی آن از حدود تهدید فراتر رود یا به طور کامل غیر قابل انتظار باشد، نابهنجار به حساب خواهد آمد. اختلال های اضطرابی، موارد زیر را شامل می شوند:
فوبی ها یا ترس های مرضی،
اختلال های وحشت زدگی،
اضطراب فراگیر، اختلال وسواس فکری –عملی و
استرس پس- آسیبی.
اختلال های خلقی
اختلال های خلقی به اختلال هایی گفته می شود که با آشوب ها و دگرگونی های شدید هیجانی همراه هستند. آشوب های هیجانی معمولا از طریق افسردگی یا برانگیختگی بیش از اندازه منعکس می شوند.
البته نباید فراموش کرد که، در بیشتر مواقع، افسردگی و برانگیختگی عادی است، مثلا، اگر در امتحان مردود شویم خیلی طبیعی خواهد بود که احساس افسردگی کنیم، یا اگر یکی از نزدیکان خود را از دست بدهیم، به شدت افسرده خواهیم بود و این کاملا طبیعی است.
اضطراب و افسردگی زمانی اختلال به حساب می آیند که اغراق آمیز باشند. مثلا، چند سال پس از فوت یکی از عزیزان، همچنان افسرده باشیم.
افسردگی یکی از اختلال های روانی بسیار شایع است که آن را، از نظر روانی به ذکام تشبیه می کنند. اشخاصی که از افسردگی عادی رنج می برند، ممکن است احساس غم کنند و افکار مالیخولیایی داشته باشند. احتمال دارد که آن ها از کمبود انرژی، افت اعتماد به نفس، دشواری در تمرکز، عدم علاقه به دیگران و فعالیت های خوشایند، احساس بدبینی و تمایل به گریه کردن و افکار منجر به خودکشی رنج ببرند.
اشخاص مبتلا به افسردگی شدید نیز معمولا همه ی احساسات بالا را نشان می دهند، با این تفاوت که شدت احساسات آن ها به ظاهر خیلی شدید است. به علاوه، احتمال دارد که آن ها اشتها و مقداری از وزن خود را از دست بدهند، تمرکز نداشته باشند، به بی اعتنایی عمومی و تلاش برای خودکشی گرفتار شوند.
نقطه ی مقابل افسردگی، سرخوشی یا شیدایی است. افراد سرخوش یا مانیک، به شدت برانگیخته می شوند، حرکات ابلهانه انجام می دهند و اشیا و لوازم را تخریب می کنند. این افراد به طور تکانشی رفتار می کنند، تند حرف می زنند، تسلسل افکار دارند، از محدوده ی خود خارج می شوند، به طور انفحاری می خندند، روی پا بند نمی شوند، دیگران را مسخره می کنند و...
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند سیگما
اوربیتال S به شکل کره است و مرکز آن در هسته اتم قرار دارد. برای تشکیل پیوند، دو هسته باید به اندازه کافی به یکدیگر نزدیک شوند تا همپوشانی مولکول های اوربیتالهای اتمی صورت پذیرد.
نشان دادن اوربیتالهای اتمی با حروف (P , S , ...) مرسوم است. اوبیتالهای مولکولی نیز با حروف یونانی ( ) سیگما،
) سیگما،
( ) (پی) و غیره نشانه گذاری میشوند.
) (پی) و غیره نشانه گذاری میشوند.
تشکیل پیوند سیگما
اوربیتالهای مولکولی (H2)، از همپوشانی دو اوربیتال (S) از دو اتم هیدروژن حاصل شدهاند. اگر همپوشانی طوری بین دو اوربیتال صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تقویت کنند، چگالی الکترونی در ناحیه بین دو هسته زیاد خواهد بود و جاذبه دو هسته با بار مثبت نسبت به ابر الکترونی اضافه با بار منفی، مولکول را به هم نگه میدارد و مولکول پایدارتر از اتمهای هیدروژن میشود. اوربیتالهای پیوندی یا اوربیتال مولکولی حاصل، اوربیتالهای سیگما و این پیوندها را پیوندهای سیگما مینامند و با نماد ( ) نشان داده میدهند.
) نشان داده میدهند.
تشکیل اوربیتال ضد پیوندی سیگما
چون دو اوربیتال اتمی با یکدیگر ترکیب شدهاند، باید دو اوربیتال مولکولی به دست آید. اوربیتال مولکولی دیگر، وقتی حاصل می شود که همپوشانی بین دو اروبیتال اتمی طوری صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تضعیف کنند.
در این حالت چگالی الکترونی در ناحیه بین دو هسته خیلی کم است.
چون دو هسته ی مثبت همدیگر را دفع میکنند و در فاصله بین آن ها، چگالی کم الکترونی قادر به جبران این دافعه با ایجاد جاذبهای قوی نیست، لذا نزدیک نگاه داشتن دو هسته در این حالت نیازمند انرژی است. این اوربیتال مولکولی را اوربیتال ضد پیوندی سیگما ( با نشان  ) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
تقارن اوربیتالهای سیگما
اوربیتالهای سیگما (پیوندی و غیرپیوندی)، به دور محوری که دو هسته را به یکدیگر متصل میکند، تقارن استوانهای دارند و چرخش مولکول دور این محور، تغییر قابل مشاهدهای در شکل اوربیتال به وجود نمیآورد.
انرژی اوربیتال پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند کمتر است، در حالی که انرژی اوربیتال ضد پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند بالاتر است.
وقتی دو اوربیتال اتمی ترکیب میشوند:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است
مرتبه پیوند
هر اوربیتال ( اتمی یا مولکولی ) میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن دو الکترون ( با اسپینهای جفت شده ) اوربیتال ( 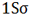 ) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (
) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (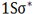 ) اشغال شده است.
) اشغال شده است.
تعداد پیوند یا مرتبه پیوند در هر مولکول عبارت است از نصف الکترون های ضد پیوندی از الکترون های پیوندی است.
مرتبه پیوند برای (H2) برابر 1 و برای (He) صفر است.
بررسی اوربیتال (2S)
ترکیب دو اوربیتال (2S)، اوربیتالهای مولکولی (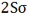 ) و (
) و ( 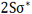 ) را به وجود میآورد که با اوربیتالهای (
) را به وجود میآورد که با اوربیتالهای (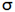 ) و (
) و ( 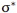 ) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند فلزی
تعریف پیوند فلزی
بین اتم های فلز در شبکه بلور پیوند ویژهای وجود دارد که در اصطلاح پیوند فلزی نامیده میشود.
توجیه پیوند فلزی
انرژی یونش فلزات نسبت به غیر فلزات نسبتا کمتر و تعداد اوربیتال های خالی لایه ظرفیت اتم آن ها نسبت به تعداد الکترون های لایه ظرفیت نیز کم است. از این رو، تعدادی از الکترون های سست لایه ظرفیت اتم فلز که در اصطلاح دریای الکترون فلزی نیز نامیده میشوند، باقیمانده اتم های فلز را که دارای بارمثبت خواهند بود، فرا میگیرد. جاذبه الکتروستاتیکی بین این ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد فلزی به وجود می آید که سرتاسر شبکه بلور فلز را گرفته است.
پیوند فلزی
جاذبه الکتروستاتیکی حاصل بین ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد، عامل پیوند بین ذرههای فلز محسوب میشود و اتصال ذرههای فلز را در شبکه و انسجام بلور فلزی را تأمین میکند. چون چنین پیوندی دارای جهت خاصی نیست و ذرههای فلز نیز امکان جابجا شدن در داخل توده ابر الکترون آزاد فلزی را در شبکه بلور دارند، از این رو، به روشنی میتوان بسیاری ازخواص ویژه مکانیکی فلزها، مانند قابلیت چکش خواری، مفتول شدن، تورق و غیره را توجیه کرد.
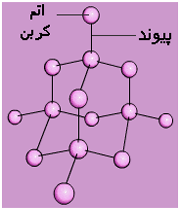
توجیه خواص فلزات با پیوند فلزی
1. رسانایی الکتریکی
جریان برق نتیجه جابجایی الکترون است. وقتی دو سر سیم برق رابه یک تکه فلز متصل کنیم از قطب مثبت جریان تعدادی الکترون از فلز خارج میشود، این کمبود الکترونی بر الکترون های غیرمستقر در فلزات اثر گذاشته، آن ها را به سمت خود میکشند. این امر باعث میشود که همان تعداد الکترون که از یک طرف خارج شده بود از طرف دیگر وارد شود و به این وسیله جریان الکتریسته انتقال یابد.
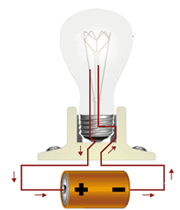
2. رسانایی گرمایی
بر اثر گرم کردن فلز، جنبش الکترون های غیر مستقر افزایش مییابد و این جنبش از یک گوشه فلز به سایر قسمت های آن منتقل میشود.
3. درخشندگی و جلای فلزات
تابش نور به سطح فلز باعث میشود که الکترون های غیر مستقر در سطح فلز برانگیخته شده و به ترازهای بالاتر انرژی بروند. بازگشت این الکترون ها باعث میشود که امواج نور مرئی از سطح فلز بازتابیده شود. در مورد فلزات رنگین بازگشت الکترون ها تنها طول موج معینی را که مربوط به رنگ فلز است بازتاب میکند.
4. پدیدههای فوتوالکتریک و ترموالکتریک
وقتی انرژی کافی (نورانی یا گرمایی) به فلز داده شود برانگیخته شدن الکترون بدان حد میرسد که الکترون از فلز جدا شود. هرگاه دستگاه مناسبی فراهم کنیم میتوانیم الکنرون جدا شده را درمدار به جریان در آورده الکتریسته تولید کنیم.
5. چکش خواری
وقتی ضربهای به فلز وارد میشود یون های مثبت در دریای الکترون منفی جابجا میشوند ولی دریای بار منفی پیوستگی تکه فلز را حفظ میکند.
طول و شعاع پیوند فلزی
در مورد فلزها اصطلاح طول پیوند فلزی، به فاصله تعادلی بین هسته دو اتم مجاور در شبکه بلور فلزها اطلاق میشود. بر حسب قرار داد نصف طول پیوند فلزی را شعاع فلزی مینامند که گاهی شعاع اتمی فلز نیز نامیده میشود.
باید توجه داشت که شعاع فلزی به سیستم بلوری فلز وابستگی دارد. یعنی اگر فلزی در چند سیستم متمایز متبلور شود شعاع فلزی آن در سیستم های گوناگون یکسان نخواهد بود. بررسیها و محاسبهها نشان داده است که هرچقدر عدد کوئوردیناسیون اتم فلز در شبکه بلور بزرگ تر باشد طول شعاع فلزی آن افزایش می یابد.
با توجه به این که در پیوند فلزی بر خلاف پیوند کوالانسی همپوشانی بین اوربیتال های دو اتم صورت نمیگیرد، انتظار میرود که طول پیوند کوالانسی آن بیش تر باشد که تجربه نیز چنین رویدادی را تأیید میکند. بدیهی است که شعاع فلزی نیز از شعاع کوالانسی بزرگتر است.
شعاع اتمی فلز قلیایی در هر دوره نسبت به شعاع اتمی عنصرهای دیگر آن دوره به نسبت بزرگتر است
پس از فلزات قلیایی خاکی در هر دوره بویژه از دوره چهارم به بعد اندازه شعاع اتمی به شدت کاهش مییابد.
این کاهش شدید اندازه شعاع را باید از یک طرف به بالا بودن سطح تراز S لایه ظرفیت اتم عنصرهای قلیایی خاکی و قلیایی و پایین بودن سطح تراز d لایه ظرفیت فلزات واسطه و گسترده بودن اوربیتال های d در این عنصر مثبت داد. زیرا به دلیل عمقی و گسترده بودن اوربیتال های d، ابر بار الکترون ها در آن ها گسترده است و اثر پوششی ناچیزی در مقابل تأثیر بار هسته اتم برلایه خارجی اتم اعمال میکنند.
از این رو بر اثر بالا رفتن بیش ازحد انتظار مقدار بار مۆثر هسته اتم فلزهای واسطه اندازه شعاع آن ها به شدت کاهش مییابد.
روند تغییر اندازه شعاعها در مورد فلزهای واسطه هر دوره جالب توجه و برخلاف روند عادی آن در مورد تغییر شعاع عنصرهای اصلی در دوره هاست. البته این روند به وضعیت الکترونی ویژه آن ها بستگی دارد. با توجه به قابلیت انعطاف و تغییر شکل ناپذیری که نتیجه قابلیت تحرک پیوند فلزی است انتظار میرود که قدرت پیوند بین دو اتم فلز در بلور فلزی از قدرت پیوند کوالانسی بین دو اتم آن در حالت گازی کم تر باشد.
انرژی پیوند فلزی
اندازه گیری گرمای تفکیک نشان میدهد که انرژی مولی پیوند فلزی در شبکه بلوری از انرژی مولی تفکیک پیوند کوالانسی آن به صورت مولکول دو اتمی بیش تر است. این رویداد را این طور میتوان توجیه کرد که پیوند فلزی به تعداد نامحدود در تمام راستا در شبکه بلور فلزی تشکیل میشود در صورتی که چنین وضعیتی در حالت گازی فلزها وجود ندارد.
از این رو با وجود این که بلور فلزی پیوستگی و پایداری زیادی دارد و پیوند فلزی در مجموع پیوندی قوی محسوب میشود. بدیهی است در هر گروه با افزایش عدد اتمی و بزرگ تر شدن طول پیوند فلزی انرژی پیوند و گرمای تفکیک مولی فلز کاهش می یابد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند کووالانسی
میلیونها ماده مرکب شناخته شده فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4 ، 5 ، 6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آن ها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
تعریف پیوند کووالانسی
یک جفت الکترون مشترک بین دو هسته یک پیوند کووالانسی تشکیل میدهند.
استحکام پیوند کووالانسی
آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند.استحکام پیوند کووالانسی ناشی از جاذبه متفابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترون های مشترکی را جذب میکنند.

دو اوربیتال به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد طبق اصل طرد پاولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. در نتیجه تشکیل پیوند اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشود.
انواع پیوند کووالانسی
پیوند یگانه کووالانسی
متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهای ازقبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند یک جفت الکترون حاصل میشود.

پیوند چند گانه
بین دو اتم ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول به وجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم پیش بینی کرد.

نماد ساختار مولکول
در ساختار اول، جفت الکترون مشترک با دو نقطه و ساختار دوم با یک خط کوتاه نشان داده شده است.
مانند :
پیوند یگانه
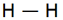
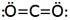
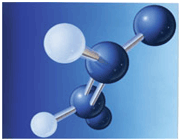
پیوند سه گانه
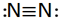


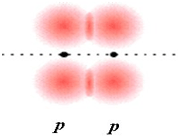
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند هیدروژنی
جاذبه بین مولکولی دربرخی از ترکیبات هیدروژندار به طور غیرعادی قوی است این جاذبه در ترکیباتی مشاهده میشود که درآن ها بین هیدروژن و عناصری که اندازه کوچک و الکترونگاتیوی زیاد دارند پیوند هیدروژنی وجود دارد. پیوند هیدروژنی نه تنها بین مولکول های یک نوع ماده، بلکه بین مولکول های دو ماده متفاوت که توانایی تشکیل پیوند هیدروژنی را دارند نیز برقرار میشود.
تعریف پیوند هیدروژنی Hydrogen Bond
هرگاه هیدروژن به اتمی با الکترونگاتیوی زیاد مثل فلوئور، اکسیژن یا نیتروژن متصل گردد، شرایطی برای به وجود آمدن نوع بسیاری مهمی جاذبه بین مولکولی مثبت ـ منفی حاصل میشودکه به آن پیوند هیدروژنی میگویند.
به عبارت دیگر، اتم یک مولکول هیدروژن و زوج الکترون غیر مشترک مولکول دیگر متقابلا همدیگر را جذب میکنند و پیوندی تشکیل میشود که به پیوند هیدروژنی مرسوم است.
نحوه تشکیل پیوند هیدروژنی
پیوند هیدروژنی بر اثر جاذبه اتم هیدروژن اندک مثبت موجود در یک مولکول و اتم بسیار الکترونگاتیو موجود در مولکول دیگر (یا در محل دیگر همان مولکول اگر مولکول به قدر کافی بزرگ باشد که بتواند روی خود خم شود) تولید میگردد.
جا به جا شدن یک جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن، اکسیژن یا فلوئور باعث میشود که این اتم ها دارای بار منفی جزئی شوند. در این صورت پیوند هیدروژنی پلی است میان دو اتم شدیدا الکترونگاتیو با یک اتم هیدروژن که از طرفی به طور کوالانسی با یکی از اتم های الکترونگاتیو و از طرف دیگر بطور الکترواستاتیکی (جاذبه مثبت به منفی) با اتم الکترونگاتیو دیگر پیوند یافته است.
استحکام پیوند هیدروژنی یک دهم تا یک پنجاهم قدرت یک پیوند کوالانسی متوسط است.
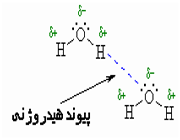
شرایط تشکیل پیوند هیدروژنی
1. بالا بودن الکترونگاتیوی اتم های متصل به هیدروژن
برهمین اساس است که فلوئور (الکترونگاتیوترین عنصر) قویترین پیوند هیدروژنی را تشکیل می دهد و اکسیژن (الکترونگاتیوتر از نیتروژن) پیوند هیدروژنی قویتری درمقایسه با نیتروژن تشکیل میدهد.
هم چنین بار مثبت زیاد بر روی اتم هیدروژن، زوج الکترون مولکول دیگر را به شدت جذب میکند و کوچک بودن اندازه اتم هیدروژن سبب میشود که ملکول دوم بتواند به آن نزدیک شود.
2. کوچک بودن اتم های متصل به هیدروژن
پیوند هیدروژنی واقعا مۆثر فقط در ترکیبات فلوئور، اکسیژن و نیتروژن تشکیل میشود. با وجود این که دو اتم نیتروژن و کلر الکترونگاتیوی برابر دارند چون اتم کلر از اتم نیتروژن بزرگ تر است بر خلاف نیتروژن، کلر پیوند هیدروژنی ضعیفی تشکیل میدهد.
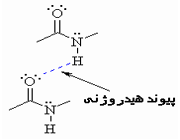
توجیه خواص غیرعادی برخی از مواد
وجود خواص غیرعادی برخی از مواد در حالت جامد یا مایع از جمله بالا بودن دماهای ذوب و جوش، نشان میدهد که نیروهای جاذبه بین مولکولی در آن ها به اندازهای زیاد است که نمیتوان آن را به تأثیرهای متقابل ضعیف بین مولکولی نسبت داد. آشناترین این نوع مواد فلوئورید هیدروژن، آب و آمونیاک است که بسیاری از خواص آن ها از جمله دماهای جوش و ذوب آن ها از دماهای جوش و ذوب ترکیب های مشابه خود به طور غیرمنتظرهای بالاتر است.
شاید تصور شود که علت این وضعیت غیر عادی، قطبیت به نسبت زیاد این مولکول هاست؛ البته تا اندازهای همین طور است، اما بررسی دقیق این پدیده غیر عادی نشان میدهد که باید نیروی جاذبه قوی تر از نیروهای جاذبه دوقطبی _ دوقطبی بین مولکول های آن ها برقرار باشد.
اگر به ساختار الکترونی مولکولی آن ها توجه شود، میتوان به موردهای مشترک بین آن ها پی برد:
این وجه اشتراک، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آن هاست
اتم هایی که الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی به شدت قطبی به وجود میآورند به طوری که هیدروژن به میزان قابل توجهی خصلت یک پروتون را پیدا میکند.
جفت الکترون ناپیوندی و قابل واگذاری روی اتم H، این امکان را پدید میآورد که اتم هیدروژن در نقش پل، اتمهای الکترونگاتیو دو مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
پیوند یونی
ترکیبات یونی که متشکل از تعداد زیادی آنیون و کاتیون هستند با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور را به وجود میآورند. هر بلور به سبب جاذبههای منفی ـ مثبت یون ها به هم نگهداشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه سادهترین نسبت یون های مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.
تعریف پیوند یونی IonicBond
پیوند یونی جاذبهای است که بین یون های مثبت و منفی وجود دارد و آن ها را در یک ساختار بلورین به هم نگه میدارد. این پیوند ناشی از انتقال الکترون بین اتم هاست.
ماهیت یون
وقتی اتمها به یون تبدیل میشوند خواص آن ها شدیدا تغییر می کند مثلا مجموعهای از مولکول های برم قرمز است، اما یون ها در رنگ بلور ماده مرکب هیچ دخالتی ندارند. یک قطعه سدیم شامل اتمهای سدیم نرم است خواص فلزی دارد و بر آب به شدت اثر میکند اما یون های آن در آب پایدارند.
به همین لحاظ است که یون های سدیم و کلر را به صورت نمک طعام میتوان بدون ترس از واکنش شدید روی گوجه فرنگی ریخت. وقتی اتمها به صورت یون در میآیند ماهیت آن ها آشکارا تغییر میکند.
خواص مواد مرکب یونی
1. رسانایی الکتریکی
رسانایی الکتریکی مواد مرکب یونی مذاب به این علت است که وقتی قطبهایی با بار مخالف در این مواد مذاب قرار گیرد و میدان الکتریکی برقرارشود یون ها آزادانه به حرکت در میآیند این حرکت یون ها بار یا جریان را از یک جا به جای دیگر منتقل میکنند. در جسم جامد که یون ها بیحرکتاند و نمیتوانند آزادانه حرکت کنند جسم خاصیت رسانای الکتریکی ندارد.
2. سختی
سختی مواد مرکب یونی به علت پیوند محکم میان یون های با بار مخالف است. برای پیوندهای قوی انرژی بسیاری لازم است تا یونها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پیداکنند. انرژی زیاد به معنی نقطه جوش بالا است که خود از ویژگیهای مواد مرکب یونی است.
3. شکنندگی
مواد مرکب یونی شکنندهاند. زیرا ساختار جامد آن ها آرایه منظمی از یون هاست. مثلا ساختار سدیم کلرید (NaCl) را در نظر بگیرید. هرگاه یک سطح از یون ها فقط به فاصله یک یون در هر جهت جابجا شود یون هایی که بار مشابه دارند درکنار یکدیگر قرار میگیرند و یکدیگر را دفع میکنند و چون جاذبهای در کار نیست بلور میشکند. سدیم کلرید را نمیتوان با چکش کاری به ورقههای نازک تبدیل کرد با چنین عملی بلور نمک خرد و از هم پاشیده میشود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
انتقال انرژی گرمایی
خورشید منبع انرژی کره ما زمین است . انرژی خورشید به درون فضا ، اتمسفر و سطح زمین منتقل میشود . از آنجائی که این انرژی سطح زمین و اتمسفر را گرم می کند مقداری از آن به انرژی گرمایی تبدیل می شود . برای انتقال گرما به درون اتمسفر سه روش وجود دارد :
*تابش *هدایت * انتقال
تابش
اگر در کنار آتش و یا شومینه ای بایستید انتقال گرما به خودتان را متوجه می شوید که به آن تابش می گوییم. طرفی از شما که به سمت آتش قرار گرفته است گرم می شود در حالی که سمت دیگر که از آتش دور است بی تاثیر از حرارت باقی می ماند . اگرچه هوا شما را احاطه کرده است ولی هیچ نقشی در انتقال این گرما ندارد . چراغ های حرارتی از این روش برای گرم نگه داشتن غذا استفاده می کنند. انتقال انرژی گرمایی در درون فضا توسط تابش های الکترومغناطیسی صورت می گیرد که به این عمل تابش گفته می شود.
بیشتر تابش های الکترومغناطیسی که از طریق خورشید به زمین می رسد به شکل نور مشاهده می شوند. نور از امواجی با فرکانس های مختلف تشکیل شده است. یک فرکانس عبارت است از دفعاتی که یک اتفاق در زمانی خاص تکرار می شود . در تابش های الکترومغناطیسی، فرکانس به دفعاتی که یک موج از یک نقطه در یک ثانیه می گذرد ، گفته می شود .
ذهن ما این فرکانس های مختلف را به شکل تفسیری از رنگ ها مثل قرمز ، نارنجی ، زرد ،سبز ،نیلی و بنفش در می آورد . هنگامی که چشم همه این رنگ ها را به طور همزمان ببیند آن را به رنگ سفید تفسیر می کند . امواجی که از سوی خورشید می آیند و ما آن ها را نمی توانیم ببینیم ر ا مادون قرمز می نامند .این امواج دارای فرکانس هایی پایین تر از قرمز می باشند. امواج ماورا بنفش نیز دارای فرکانس هایی بالاتر از بنفش هستند .

بسیاری از تابش های خورشیدی که به سطح زمین تابیده می شود توسط اتمسفر جذب می شود که حجم بیشتری از این تابش ها از سطح زمین به اتمسفر بازتاب می شود تا به صورت انرژی گرمایی دربیاید. اجسام به رنگ تیره مثل آسفالت کف خیابان انرژی پرتویی بیشتری را جذب می کنند و زودتر از اجسام با رنگ روشن گرم می شوند . همچنین اجسام با رنگ تیره انرژی موجود در خودشان را سریع تر ازاجسام با رنگ روشن تابش می کنند.
هدایت گرما
به جابه جایی انرژی گرمایی ازیک ماده به ماده دیگر ویا درون یک ماده را هدایت گرما می نامیم. آیا هرگز یک قاشق فلزی را در کنار ظرف سوپی که هنوز بر روی اجاق گاز است گذاشته اید؟ بعد از زمانی کوتاه دسته قاشق داغ خواهد شد. این اتفاق در نتیجه انتقال انرژی از یک مولکول به مولکول دیگر ویا یک اتم به اتم دیگر صورت می گیرد. همچنین هنگامی که اجسام در تماس با یگدیگر قرار دارند فلز از طریق انتقال انرژی گرم می شود.(نارنجی / قرمز برافروخته ). به این امر هدایت گرمایی گفته می شود که یکی از راه های موثر در انتقال انرژی در فلزات است. لازم به ذکر است که عمل هدایت گرمایی در هوا بسیار ضعیف انجام می گیرد.

انتقال
به جابه جایی انرژی گرمایی در مایعات انتقال گفته می شود .در آشپزخانه هنگامی که یک مایع در حال جوشیدن است می توان این نوع گرما را مشاهده کرد. هوا در درون اتمسفر همانند یک سیال عمل می کند . وقتی تابش های خورشید با زمین برخورد می کنند سنگ ها را گرم می کنند . همچنان که دمای سنگ در اثر هدایت گرمایی زیاد شد انرژی گرمایی به صورت حبابی از هوا که گرمتر از هوای اطراف سنگ است وارد اتمسفر میشود. حباب هوا هم چنان که به سمت اتمسفر بالا می رود شروع به سرد شدن می کند.

همچنان که این توده گرم بالا می رود با هوای اطرافش که سردتر است جابه جا می شود و به این ترتیب هوایی با غلظت بیشتر ایجاد شده ، که این همان چیزی است که ما آن را باد می نامیم.
این جابه جایی توده های هوا دربعضی مناطق بسیار کم است. مثل ابرهای محلی کیومولوس ویا چرخه های وسیع در تروپوسفر که بخش بزرگی از زمین را پوشش می دهند. در تروپوسفر، بسیاری از قالب های هوایی از طریق جریان انتقال ایجاد می شوند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:

عناصر گروه دوم در جدول تناوبی (فلزات قلیایی خاکی) هریک دو الکترون والانس دارند. پس برای این که mg ، ca ، sr ، ba ساختار گاز نجیب را به دست آورند اتمهای هرعنصر باید دو الکترون از دست بدهند.
از دست رفتن دو الکترون موجب میشود که، دو پروتون در هسته خنثی نشده بماند. پس هر یون بار +2 خواهد داشت. برای جدا شدن سومین الکترون لازم است جفت الکترون های تراز اصلی با انرژی پایینتر شکسته شود. این امر انرژیِ زیادتری میخواهد. جداشدن الکترون ها از فلزات و تشکیل یون های مثبت حاصل از آن ها را میتوان به راه های مختلف ترسیم کرد.
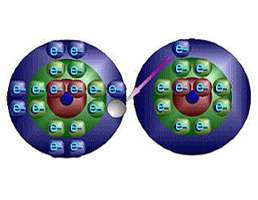
پس از جدا شدن یک الکترون از یک اتم معین، جداشدن الکترون های بعدی به ترتیب مشکل تر میشود. زیرا با از دست رفتن هر الکترون، بار مۆثر هسته زیادتر میشود و هسته، الکترون های باقیمانده را محکم تر نگاه میدارد. به طور خلاصه، یون های مثبت وقتی تشکیل میشوند که اتمهای فلزی یک الکترون (گروهIA ) دو الکترون (گروهIIA) و یا سه الکترون (گروهIIIA) به اتمهای غیر فلزی میدهند. یون های حاصل آرایش الکترونی یکسان با یک گاز نجیب دارند.
هالوژن ها
یون های مثبت، در حضور یون های منفی پایدار میشوند. خنثی شدن بار، هر دو نوع یون را پایدار میکند. یون های منفی پایدار، از اتمهایی که شش الکترون والانس دارند و هر یک، یک الکترون میخواهند تا به آرایش الکترونی هفت الکترون والانس برسند، تولید میشوند.
این گونه اتمها آن قدر الکترون بدست میآورند تا ساختار گاز نجیب را پیدا کنند. مثلا اتمهای عناصر گروه VIIA (هالوژنها) هفت آرایش یک گاز نجیب را پیدا می کنند. اگر اتمهای F ، Cl ، Br ، I هر یک، یک الکترون به دست آورند، یون های حاصل به ترتیب آرایش الکترونی گاز های نجیب را خواهند داشت.
گروه اکسیژن
اتم عناصر ششم (VIA) برای رسیدن به ساختار الکترونی یک گاز نجیب هریک دو الکترون نیاز دارند. روند به دست آوردن الکترون توسط غیرفلزات، مانند از دست دادن الکترون توسط فلزات را میتوان به راه های متفاوت ترسیم کرد. به طور خلاصه غیرفلزات یک، دو یا سه الکترون از فلزات میگیرند و یون منفی ایجاد میکنند این یون های منفی همگی الکترون های والانس جفت شده و آرایش هشت الکترونی پایدار گازهای نجیب را دارند.
فرمول شیمیایی مواد مرکب یونی
فرمول شیمیایی یک ماده مرکب از لحاظ الکتریکی خنثی است. خنثی بودن الکتریکی مستلزم آن است که شمار بارهای مثبت و منفی در بلور ماده مرکب برابر باشند. در بلور نمک طعام یون های با جاذبه الکتریکی میان بارهای مخالف درجای خود نگاه داشته شدهاند.
علاوه بر این برای خنثی بودن این ماده مرکب باید نسبت یون های سدیم به یون های کلرید 1 به 1 باشد. در این صورت سادهترین فرمول آن خواهد بود. در ساختار بلورین هر یون سدیم با هر شش یون کلرید اطراف آن جذب میشود. به همین طریق هر یون کلرید با هر شش یون سدیم اطراف آن جذب میشود در ساختارهای یونی هیچ مولکول تک اتمی وجود ندارد، یعنی هیچ یون خاصی وجود ندارد که منحصرا به یک یون دیگر بپیوندد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
















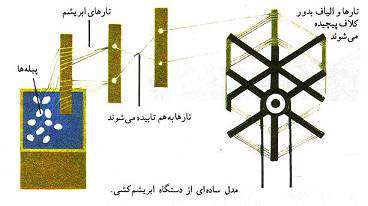











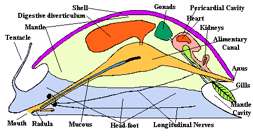

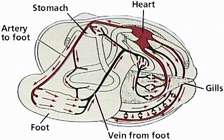
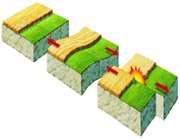
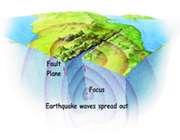
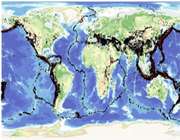
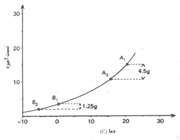
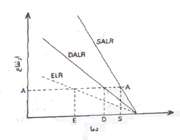
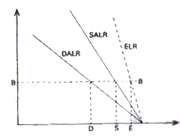
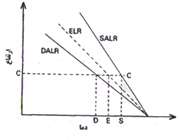
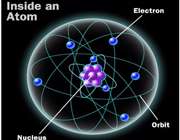
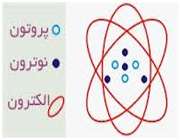
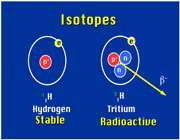
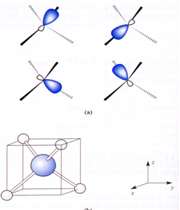
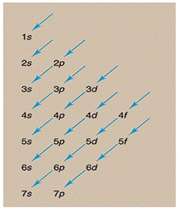
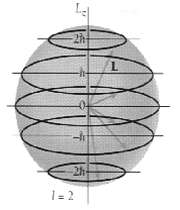
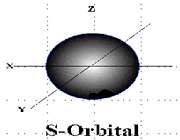
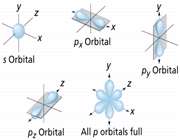
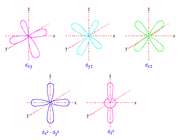
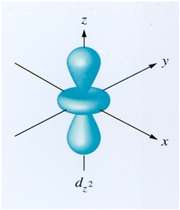
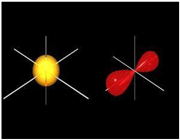
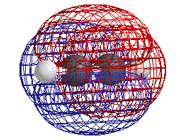

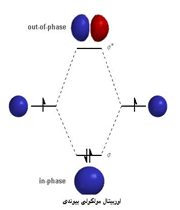
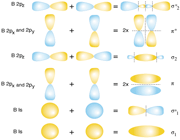
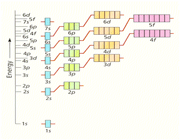


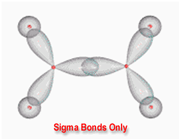
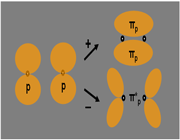
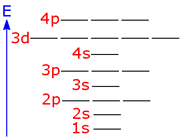
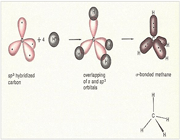
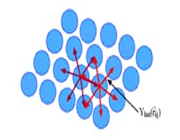

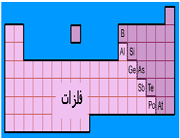
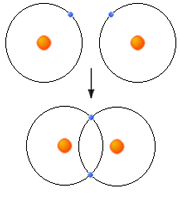
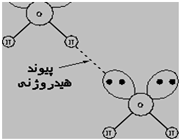
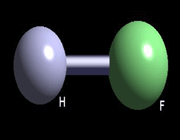
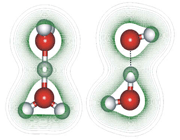
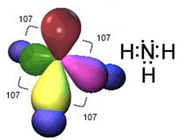
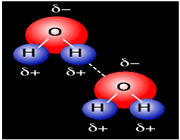
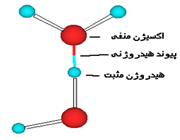
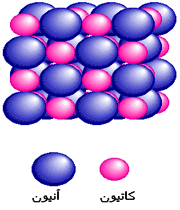
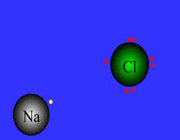
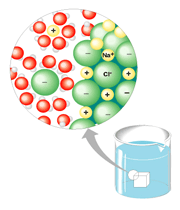
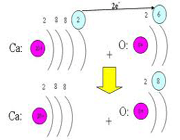


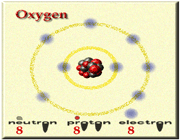
 آمار
وب سایت:
آمار
وب سایت:

