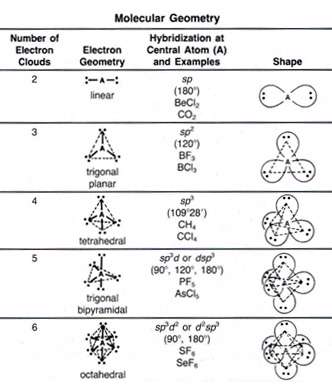
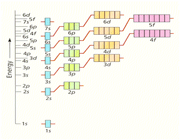
انواع اوربیتال هیبریدی
اوربیتال هیبریدی SP

درگیر شدن تمام اوربیتال های پوسته والانس اتم مرکزی یک مولکول، در تشکیل اوربیتال های هیبریدی ضرورت ندارد. تنها آن تعداد از اوربیتال های مزبور برای تشکیل اوربیتال های هیبریدی مورد استفاده قرار میگیرند که تعداد پیوند لازم و نیز شکل هندسی مولکول را تأمین کنند. برای مثال توابع موجی سه اوربیتال هیبرید را میتوان از ترکیب ریاضی توابع موجی یک اوربیتال S و دو اوربیتال P به دست آورد. یکی از سه اوربیتال P، در این عمل شرکت نمیکند.
اوربیتال هیبریدی SP3
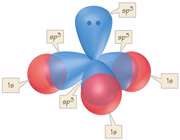
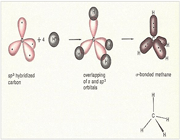
هیبریداسیونSP3 یک نوع مهم و متداول میباشد. این اوربیتالها از هیبرید شدن یک اوربیتال S و 3 اوربیتال P تشکیل میشوند.

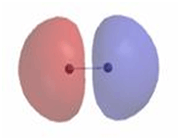
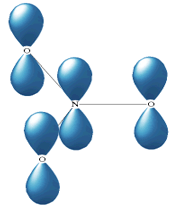
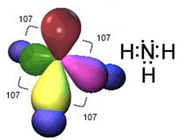
اوربیتال هیبریدی SP3 با یک جفت الکترون غیر پیوندی: در مولکولهایی مانند NH3 میتوان تصور کرد که اتم نیتروژن از اوربیتالهای هیبریدی SP3 استفاده کرده است، که یکی از آن ها توسط یک جفت الکترون غیر مشترک اشغال شده است. اتمهای مولکول یک هرم مثلثی تشکیل میدهند. ولی آرایش 4 اوربیتال N تقریباً به صورت یک 4 وجهی است و زاویه پیوند تقریبا برابر با 107 درجه میباشد.
اوربیتال هیبریدی SP3 با دو جفت الکترون غیر پیوندی: اتم اکسیژن هم در مولکول H2O از اوربیتالهای SP3 استفاده میکند که در آن دو اوربیتال هیبریدی توسط دو جفت الکترون غیر مشترک اشغال شدهاند. زوایای اتم و 104/5 0 میباشد که این زاویه به 1090 نزدیک تر است تا به 900 ، که در صورت به کار رفتن اوربیتال خالصP، انتظار میرفت.
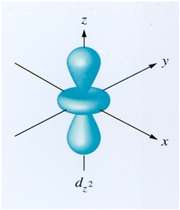
اوربیتال هیبریدی دارای اوربیتال d
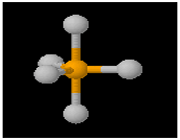
اوربیتالهای d2SP3 : این اوربیتالها از هیبرید شدن 2 اوربیتال d و یک اوربیتال s و 3 اوربیتال p به وجود میآیند.
هر 6 اوربیتال با یکدیگر همارز بوده و به سوی گوشههای یک هشت وجهی منتظم جهت گیری دارند. یک نوع از این ها با یک جفت الکترون غیر پیوندی (این اوربیتال دارای شکل هرم، با قاعده مربع) بوده و نوع دیگرش با دو جفت الکترون غیر پیوندی (این اوربیتال دارای شکل مربع مسطح) میباشد.

اوربیتال اتمی dx2 - y2: در تشکیل این اوربیتال هیبریدی دخالتی ندارد. پنج اوربیتال حاصل با یکدیگر همارز نیستند. این اوربیتالها در گوشههای یک دو هرمی مثلثی جای میگیرند. زاویه بین پیوندهایی که در قاعده قرار گرفتهاند 1200 و پیوندهای خارج از قاعده 900 و زاویهای که دو راس هرم را به هم وصل میکند 1800 میباشد.

نکات مهم در هیبریداسیون اوربیتالها
• محاسبات نشان میدهد که استفاده از اوربیتالهای هیبریدی به تشکیل پیوندهای قوی تر منجر میشود.
• انرژی لازم برای ایجاد حالت برانگیخته و هم چنین انرژی لازم برای هیبرید شدن، بیش تر از انرژی آزاد شده به هنگام تشکیل دو پیوند نسبتا قوی کوالانسی است.
• اوربیتالهایی که در آن ها دو نوع معینی از هیبریداسیون به کار رفته است، باید از لحاظ انرژی نسبتا به هم نزدیک باشند.
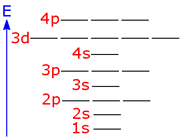
• اوربیتالهایی که معمولاً در تشکیل پیوند به کار میروند اوربیتالهای d , p , s لایه خارجی و در برخی موارد اوربیتال d لایه ماقبل لایه خارجی هستند. به استثنای این اوربیتالهای d داخلی، الکترونهای اوربیتالهای داخلی معمولاً آن قدر به هسته وابسته هستند که نمیتوانند در تشکیل پیوند شرکت کنند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
چرخه شناسایی آب
در اتمسفر زمین سیستم گردش آب به طور پیوسته وجود دارد. در درون این چرخه، جریان آب از سمت زمین به سوی اتمسفر و مجددا با برگشت به سوی زمین صورت می گیرد.
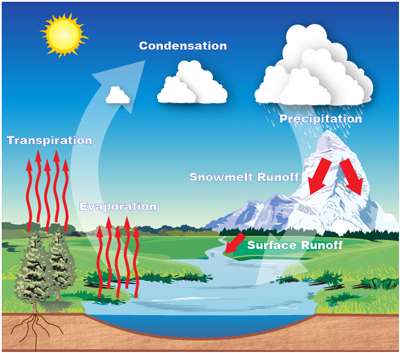 |
اگرچه مراحل زیادی در شکل گیری این چرخه وجود دارند ولی مهم ترین آن ها به شرح ذیل می باشند.
- تبخیر
- فراتراوش
- میعان
- بارش
- جاری شدن
تبخیر
به تغییر فرم ماده، از حالت مایع به حالت گاز تبخیر می گوییم. در علم هواشناسی ماده مورد نظر آب می باشد. برای این که تبخیری صورت بگیرد نیازمند مقداری انرژی هستیم.
این انرژی را از منابع متعددی مثل خورشید، اتمسفر، زمین و یا موجودات روی زمین مانند انسان می توان گرفت. همه ما تجربه هایی پیرامون موضوع تبخیر داریم . هنگامی که دمای بدن ما در اثر گرمای هوا و یا ورزش کردن بالا می رود بدن عرق کرده و آب روی پوست ظاهر می شود.
این اتفاق به این دلیل می افتد که بدن از گرمای درون خودش برای تبخیر مایع استفاده می کند و به این ترتیب گرما از بین رفته و بدن سرد می شود. هم چنین هنگامی که شما از زیر دوش یا استخر بیرون می آیید همان تاثیر را می بینید. احساس خنکی شما به دلیل رفع گرمای بدن برای ایجاد بخار آب روی پوست (عرق) است.
فراتراوش (بخار کردن )
به تبخیر آب از طریق منافد گیاهان عمل (فراتراوش – تنفس ) گفته می شود. منافذ به دریچه های ریزی گفته می شود که در زیر برگ وجود دارد و به بافت آوندی گیاه متصل شده اند. در اکثر گیاهان، عمل فراتراوش طی مراحلی که اغلب توسط رطوبت اتمسفر و نم موجود در خاک کنترل می شود، صورت می گیرد. فقط یک درصد از آبی که از طریق ریشه وارد گیاه می شود، جهت مراحل رشد مورد استفاده گیاه قرار می گیرد. مابقی آن که 99 درصد می باشد وارد اتمسفر می شود.
میعان
در عمل میعان، بخار آبی که در اتمسفر وجود دارد تبدیل به مایع می شود. در اتمسفر میعان به شکل ابر و یا شبنم مشاهده می شود. وقتی که آب بر دیواره قوطی ویا بطری نوشابه ای که بدون درپوش است می نشیند در اصطلاح می گوییم میعان رخ داده است.
میعان در یک دمای خاص اتفاق نمی افتد بلکه معمولا در اختلاف بین دو دما شکل می گیرد. مانند تفاوتی که بین دمای هوا و نقطه شبنم وجود دارد. در یک بیان ساده نقطه شبنم به دمایی که شبنم در آن شکل می گیرد گفته می شود. در واقع دما نقش مهمی در این مورد ایفا می کند به این صورت که اگر هوا به سطح مشخصی از سرما برسد اشباع می شود. هر نوع افزایش در آن دما باعث تبدیل بخار آب به مایع می شود.
اغلب هنگامی که دمای هوا و دمای نقطه تشکیل شبنم برابر شود مه تشکیل می شود. میعان نقطه مقابل تبخیر است. از آنجایی که بخار آب نسبت به آب، در حالت مایع، از سطح انرژی بالاتری برخوردار است، هنگامی که میعان صورت می گیرد، انرژی اضافی به شکل انرژی گرمایی آزاد می شود. این آزاد سازی گرما در شکل گیری گردباد نقش دارد.
بارش
هنگامی که قطرات کوچک در میعان به هم می پیوندند، و به قطرات بزرگ تری تبدیل می شوند، قطرات باران ایجاد می شود که با افزایش تراکم قطرات بارش، به سمت زمین فرو می ریزد.
بارش به صورت های مختلف مثل باران، تگرک، برف و یا باران دیده می شود.
بارش یکی از ساده ترین راه ها برای دریافت آب تازه در زمین است. به طور میانگین خشکی ها و دریاهای کره زمین سالانه حدود 5/38 اینچ (980 میلی لیتر ) آب از طریق بارندگی دریافت می کنند.
جاری شدن آب
وقتی بارش ها از حد ظرفیت زمین بیش تر شوند و زمین اشباع گردد،( یعنی دیگر آب را به خود جذب نکند )، عمل جاری شدن آب اتفاق می افتد. رودخانه ها ودریاچه ها در اثر این جریان آب به وجود می آیند. در حرکت آب به سوی رودخانه ها و دریاچه ها مقداری عمل تبخیر هم صورت می گیرد ولی بیشتر آب به اقیانوس ها برمی گردد.
اگر آب به گونه ای باشد که فقط وارد دریاچه شود و دریاچه خروجی نداشته باشد تا آب از آن خارج شود، تنها راه بازگشت آب به اتمسفر تبخیر آن است. با عمل تبخیر، تنها آب خالص بخار می شود و بنابراین هر گونه آلودگی و نمک برجای خواهد ماند ودر نهایت دریاچه نمکی خواهیم داشت.
در تبخیر آب به سوی اتمسفر ، جریان آب دوباره برقرار می شود. قسمتی از آب به درون خاک و زمین نفوذ می کند تا دوباره توسط گیاهان جذب شده و عمل پس دادن بخار (فرا تراوش ) صورت بگیرد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تولید مثل

همه ی جاندارانی كه پیرامون ما هستند یا تك سلولی و یا پر سلولی هستند هر یك از این جانداران توانایی دارند كه هم نوع خود را به وجود آورند. به عبارت دیگر تولید مثل كنند.
اهمیت تولید مثل:

همه ی موجودات زنده برای بقای خود فعالیت هایی مانند: تنفس كردن، رشد كردن، .... انجام می دهند. اما یكی از مهم ترین كارهای موجودات زنده فعالیت در جهت بقای نسل خود است.
اگر جانداری نتواند فعالیت غیر تولید مثل انجام دهد از بین می رود اما اگر این گونه از جانداران نتوانند فعالیت تولید مثل انجام دهد نسل جاندار منقرض خواهد شد. بقای نسل در جاندار به عوامل ارثی محیطی جاندار مربوط می شود.
توانایی مقاومت یك جاندار در برابر بیماری ها، شكار شدن، عوامل محیطی، آب و هوا، تغییرات دما، بلایای طبیعی مانند زلزله، سیل، آتشفشان از جمله عوامل محیطی و ارثی هستند.

در تولید مثل غیر جنسی، جاندار به مرحله ای از رشد خود كه می رسد می تواند تكثیر شود و افراد جدیدی را به وجود آورد. بسیاری از جانداران ساده كه ساختمان بدنی ساده ای دارند و برخی گیاهان به این روش زیاد می شوند مانند: باكتری ها، تك سلولی ها، برخی گیاهان و جانداران.
در روش تولید مثل غیر جنسی همه ی جانداران تكثیر یافته یك گونه و كاملا مانند هم بوده و خصوصیات ساختمانی و حیاتی یكسانی دارند. در این جانداران اگر شرایط محیطی تغییر كند و این شرایط برای جاندار مضر باشد همه ی نسل آن ها از بین می رود.

دونیم شدن:
در این روش یك جاندار مانند: آسیب تقسیم می شود و به جاندار كه از نظر اندازه تقریبا ساده است تبدیل می شود.
جوانه زدن:
بعضی از جانداران مانند هیدر به این روش زیاد می شوند در این روش برآمدگی كوچكی در بدن جاندار ایجاد می شود و كم كم به جانداری مستقل تبدیل شده و ممكن است از بدن جاندار اولیه جدا شود یا هم چنان متصل باقی بماند مانند: هیدر آب شیرین و مخمرنان.
قطعه قطعه شدن:
در این روش، بدن جاندار به چندین قطعه تقسیم می شود. سپس بعضی، یا همه ی آن ها به جاندار بالغ تبدیل می شوند. مثلا جلبك اسپیروژیر با این روش زیاد می شود. این گیاهان نیز با روش تولید مثل غیرجنسی زیاد می شوند.
تولید مثل رویشی در گیاهان به دو طریق طبیعی و مصنوعی صورت می گیرد.

ساقه زیر زمینی:
بعضی از گیاهان با ساقه زیر زمینی زیاد می شوند،ساقه های زیر زمینی كلروفیل ندارند و دارای برگ های قهوه ای فلس مانند دارند.

ریزم:
ریزم تقریبا به صورت افقی در خاك رشد می كند در انتهای این ساقه ها جوانه انتهای وجود دارد، مانند مهد سلیمان.
غده:
غده به منزله ی انتهای ساقه است كه دارای اندوخته غذایی است مانند سیب زمینی.
پیاز:
در پیاز تعدادی برگ بدون سبزینه وجود دارد كه اطراف جوانه قرار دارد. (مانند پیاز خوراكی) سنبل.

بنه:
بنه نسبت به پیاز ساقه بزرگ تری دارد اما فاقد فلس های متعدد است، مانند: زعفران و گلایل.
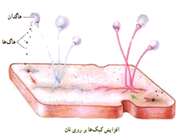
هاگزایی:
در این روش تولید مثل هاگ به وجود می آید هاگ یك سلول ویژه است كه توسط جاندار اولیه تولید می شود. و به تنهایی و به طور مستقیم جاندار به وجود می آورد. مثلا در كپك نان هاگ ها در اندام هایی به نام هاگدان تولید می شود. پس از رسیدن هاگ در هاگدان، هاگدان پاره می شود و هاگ ها همراه باد و آب به نقاط مختلف می روند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تولید مثل ( 2)
در مقاله ی گذشته مطالبی در رابطه با تولید مثل دانستیم. در این ادامه خواهیم دانست...
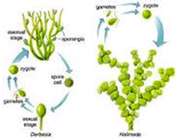
تولید مثل جنسی:
در این روش تولید مثل، باید دو نوع سلول جنسی نر و ماده وجود داشته باشد. این سلول ها با هم تركیب شده و اولین سلول جاندار جدید كه سلول تخم نام دارد به وجود می آید.
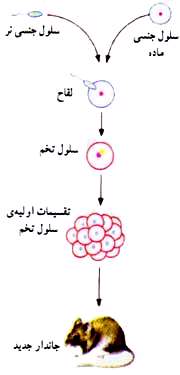
بنابر این در روش تولید مثل جنسی، گامت نر (سلول جنسی نر) و گامت ماده (سلول جنسی ماده) در اندام های تولید مثل نر و ماده تولید می شود و از تركیب آن ها سلول تخم به وجود آید. به تركیب شدن سلول نر و ماده لقاح می گویند.
تولید مثل جنسی در گیاهان گل دار:
بیشتر گیاهان با كاشتن دانه زیاد می شوند و دانه ها توسط گل ها تشكیل می شوند.
گل اندام تولید مثلی در گیاهان گل دار است. در گیاهان پیدایش گل موجب آغاز دوره ی جدید (تولید مثل جنسی گیاه) است. نقش گل، تشكیل گامت ها و فراهم كردن شرایط تركیب آن ها با یكدیگر است.
بعضی از گل ها ممكن است یك یا چند بخش دانه داشته باشند كه به آن ها گل ناقص می گویند.
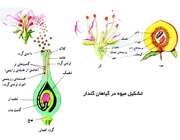 هنگامی كه دانه گرده در درون بساك پرچم كامل می شود كیسه بساك پاره شده و دانه ها پراكنده می شوند و توسط عوامل مختلف مانند باد، حشرات و ... پراكنده می شوند.
هنگامی كه دانه گرده در درون بساك پرچم كامل می شود كیسه بساك پاره شده و دانه ها پراكنده می شوند و توسط عوامل مختلف مانند باد، حشرات و ... پراكنده می شوند.

چنان چه دانه ی گرده ی یك گل، روی كلاله مادگی همان گل بیفتد، گردافشانی را مستقیم، و چنان چه دانه گرده ای روی كلاله مادگی گل دیگر از همان نوع قرار گیرد گرده افشانی را غیر مستقیم می گویند.
در درون دانه ی گرده دو نوع هسته رویشی و زایشی وجود دارد. از تقسیم شدن هسته زایشی سلول جنسی نر (گامت نر) به وجود می آید.
گامت نر با گامت ماده ی موجود در تخمدان تركیب می شود و سلول تخم به وجود می آید. سلول تخم، درون تخمك قرار دارد تبدیل به دانه و تخمدان تبدیل به میوه می شود.
بنابر این میوه، تخمدان رشد كرده و رسیده ی گل است كه ممكن است قسمت های دیگر گل را نیز به همراه داشته باشد. میوه ی موجب حفاظت از دانه و موجب پراكندگی و زمانبندی لازم برای رویش دانه می شود.
تولید مثل جنسی در جانوران:
در جانداران نیز مانند گیاهان سلول جنسی نر (اسپرم) در اندام تولید مثلی نر (بیضه) و سلول جنسی ماده تخمك در اندام تولید مثلی ماده به وجود می آید. در همه ی مهره داران و بعضی از بی مهره ها اندام تولید مثلی نر و ماده در دو جاندار جدا از هم وجود دارد، اما مانند اسفنج ها، مرجان ها، بعضی كرم ها، نرم تنان.
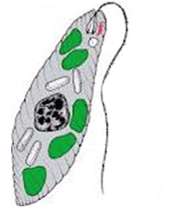
در بعضی از جانداران ساده تر:
روش تولید مثل جنسی در جانداران متفاوت است اما دو ویژگی مشترك در این روش ها وجود دارد.
(كامت نر و ماده باید با هم برخورد كنند و تركیب شوند و سلول تخم به وجود آید.)


تولید مثل در انسان:
تولید مثل در انسان نیز مانند سایر پستانداران با تشكیل سلول جنینی نر (اسپرم) بیضه و سلول جنسی ماده یا تخمك در تخمدان و تركیب هسته های آن ها با یكدیگر و ایجاد سلول تخم صورت می گیرد.
غدد جنسی در مردان بیضه و در زنان تخمدان نام دارد. وظایف غدد جنسی تولید گامت و هورمون های جنسی است.
بیضه:
بیضه ها شامل یك جفت غده هستند كه در زیر شكم و درون كیسه بیضه قرار دارند. این غدد شامل لوله های نازك و پرپیچ و خمی هستند كه به لوله های اسپرم ساز موسومند. این لوله ها عمل اسپرم سازی از دوران بلوغ شروع می كنند و تا پایان عمر ادامه می دهند.
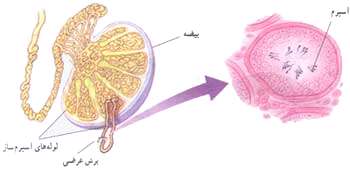
تخمدان ها شامل دو عدد غده ی بیضی شكل است كه در دو طرف داخل شكم، در پایین و جلوی روده ها قرار دارند تخمدان ها، تخمك سازی را ازدوران بلوغ شروع كرده و تا حدود 30 الی 40 سالگی ادامه می دهند.
معمولا هر ماه یك تخمك نارس فعال می شود و به یك تخمك كامل تبدیل می شود این سلول به و سیله ی لوله های فالوب به دورن رحم انتقال می یابد و چنان چه با سلول نر یا اسپرم تركیب شود به سلول تخم تبدیل می شود تخم با تقسیمات خود جنین را به وجود می آورد كه از طریق جفت با خون مادر ارتباط غذایی پیدا می كنند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
یادگیری

همان گونه که مستحضرید اهمیت علم روان شناسی درکشورمان به صورت مدرن آن در چند دهه ی اخیر، بیش از پیش آشکار شده است.
به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
برای یادگیری تعاریف متفاوتی بیان شده است. مثلا: یادگیری یعنی تغییر نسبتا دایمی رفتار که در اثر تجربه حاصل می شود.
بنابر این تعریف تغییرات رفتار در اثر رشد یا تغییرات فیزیولوژیک یادگیری محسوب نمی شوند، فرضا وقتی کودک به یک سالگی می رسد، تغییراتی از نظر قد و وزن پیدا می کند یا وقتی در تاریکی قرار می گیریم تغییراتی در دستگاه بینایی ما به وجود می آید، اما هیچ یک از این دو، یادگیری به حساب نمی آید.

غیر از بازتاب های طبیعی، تقریبا همه رفتارهای انسان تحت تأثیر یادگیری است، اما در مورد حیوانات این طورنیست، رفتار حیوانات تا اندازه ی زیادی غریزی یا ذاتی ست.
ماهی ها وقتی به دنیا می آیند شناکردن می دانند. سارها به طور غریزی می دانند که چگونه آواز بخوانند و چگونه لانه درست کنند. اما تنوع و پیچیدگی رفتار انسان اصولا نتیجه یادگیری از راه تجربه است.
تجربه برای یادگیری راه رفتن، حرف زدن به زبان مادری و محیط، جنبه بنیادی دارد. ما خواندن، محاسبه کردن، و استفاده ی سمبلیک ازتصاویر هندسی را می آموزیم. یاد می گیریم که وقتی گرسنه هستیم به دنبال غذایی برویم که در فرهنگ ما پذیرفته شده است. نوع غذایی را که انتخاب می کنیم، به ارث نبرده ایم، بلکه به مرور یاد گرفته ایم. رفتار هایی که از نظر اجتماع قابل پذیرش یا غیر قابل پذیریش هستند، یاد می گیریم.
یکی از جنبه های یادگیری، شرطی شدن است.
شرطی شدن یعنی بین دو رویداد ارتباط برقرار کردن، به نحوی که وقتی یکی ظاهر شد، دیگری نیز ظاهر شود. برای نمونه مسلما در رانندگی دیدن چراغ قرمز می ایستیم نه چراغ سبز.
این دانش را که با دیدن چراغ قرمز توقف کنیم، بدو تولد نداشتیم. در واقع ما معنای این علایم را یاد گرفته ایم. چون آن ها با سایر رویداد همراه شده اند، یعنی رعایت قانون ترمز با قرمز شدن چراغ باعث جلوگیری از تصادفات رانندگی و جریمه شدن، شده است، ما آن را انجام می دهیم.
ایوان پاولف فیزیولوژیست روسی اولین کسی بود که این نوع یادگیری، یعنی ایجاد پیوند بین رویداد ها را مورد مطالعه قرار داد.
او در جریان تحقیقات خود روی سگ ها کشف کرد که حیوانات نیز می توانند بین رویداد ها ارتباط برقرار کنند. در آزمایشات پاولف وقتی گوشت در دهان سگ قرار می گرفت، حیوان بر اساس ساخت زیستی خود، بزاق تراوش می کرد. ترشح بزاق در برابر گوشت، یک پاسخ طبیعی یا غیر اکتسابی یا غیر شرطی است که بازتاب نامیده می شود.
در این جا گوشت محرک نامیده می شود، یعنی عاملی که موجب واکنش ارگانیسم می گردد.
پاولف نشان داد که بازتاب ها نیز در اثر ارتباط، آموخته یا شرطی می شوند. مثلا صدای سینی غذا، حتی صدای پای دستیار آزمایشگاه، باعث ترشح بزاق حیوان می شد. در واقع یاد گرفته بود.
پاولف این نوع پاسخ های بزاقی را بازتاب های شرطی نامید. این بازتاب ها به شرطی ایجاد می شوند که محرک خنثی مثلا در اینجا، صدای سینی غذا و محرک غیر خنثی که در این جا خود غذاست، _و به طور طبیعی پاسخ ترشح بزاق را ایجاد می کند_ بار ها با یکدیگر همراه شوند.
امروزه بازتاب های شرطی را معمولا پاسخ های شرطی می نامند. بنابراین پاسخ شرطی، آموخته می شوند.
پاولف آزمایش خود را با کمی تفاوت چند بار تکرار کرد. بدین ترتیب که مدت کوتاهی پیش از دادن غذا به حیوان، زنگی را به صدا در آورد. پس از چند بار تکرار، سگ در مقابل صدای زنگ نیز براق ترشح می کرد، چون بین صدای زنگ و به دنبال آن، غذا ارتباط برقرار کرده بود. و در واقع شرطی شده بود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 1
هنگام ایجاد یک پیوند بین دو اتم، اوربیتالهای اتمی آن ها با یکدیگر همپوشانی کرده و اوربیتالهای مولکولی را پدید میآورند. در این اوربیتالها، الکترونها در یک محیط مولکولی تحت تاثیر دو هسته قرار دارند و بر حسب قاعده آفبا در این اوربیتالها چیده میشوند.
اوربیتالهای مولکولی را با توجه به این که از همپوشانی کدام اوربیتال اتمی پدید آمده باشند،باحروف یونانی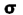 (سیگما) و
(سیگما) و 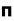 (پی) نمایش میدهند.
(پی) نمایش میدهند.
هنگام تشکیل یک پیوند، دو اوربیتال مولکولی حاصل میشود که با توجه به سطح انرژی، نسبت به اوربیتالهای اتمی به اوربیتالهای مولکولی پیوندی و ضد پیوندی شهرت دارند. به همان اندازه که اوربیتال مولکولی پیوندی، مولکول را پایدار میکند، اوربیتال مولکولی ضد پیوندی باعث ناپایداری پیوندی میشود.
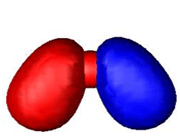
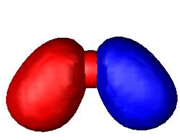
اوربیتال پیوندی
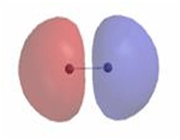
اوربیتال ضد پیوندی
با توجه به نارسایی های نظریه پیوند ظرفیت، هوندا در سال 1928 و مولیکن در سال 1931 نظریه دیگری بر اساس مدل موج اتم در مورد چگونگی تشکیل پیوند کووالانسی ارائه دادند که نظریه اوربیتال مولکولی نام گرفته است و به کمک آن بسیاری از خواص مغناطیسی، ترازهای انرژی، خواص طیفی و ... را به روشنی میتوان توجیه کرد.
در این نظریه برعکس نظریه پیوند (که فقط دخالت لایه ظرفیت اتمها را در تشکیل پیوند در نظر میگیرد) تمام اوربیتال های اتم میتواند در تشکیل اوربیتال های مولکولی شرکت داشته باشد و این اوربیتال ها بین چندین اتم و حتی در سراسر مولکول گسترده یا غیر مستقرند.
علاوه بر اوربیتال های پیوندی و غیر پیوندی، اوربیتال های ضد پیوندی نیز در تشکیل پیوند و توجیه پایداری و یا ناپایداری مولکول در نظر گرفته میشود و به تعداد اوربیتال های اتمی شرکت کننده، اوربیتال های مولکول تشکیل میشود.
شرایط همپوشانی اوربیتال ها
برای اینکه اوربیتال های اتمی بتوانند در حد تشکیل پیوند با یکدیگر همپوشانی کنند، باید دو شرط زیر درباره آن ها برقرار باشد:
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که، دریک سطح انرژی قرار داشته و یا سطوح انرژی آن ها به اندازه کافی به یکدیگر نزدیک باشد.
مثلا اوربیتال 3P یک اتم کلر می تواند فقط با اوربیتال 3P اتم دیگر کلر همپوشانی کند. اوربیتال S اتم H نمیتواند با اوربیتال 1S یا 2S و … اتم کلر همپوشانی کند، زیرا در سطح انرژی بالاتری نسبت به آنها قرار دارد.
فقط اوربیتال هایی میتوانند با یکدیگر همپوشانی کنند که نسبت به محور اصلی مولکول تقارن یکسانی داشته باشند. از این رو، مثلاً اوربیتال S که تقارن کروی دارد، در تشکیل مولکول های خطی میتواند با اوربیتال 2P که نسبت به محور اصلی مولکولی (محور Z) تقارن کامل دارد همپوشانی داشته باشد.
انواع اوربیتال های مولکولی
اوربیتال مولکولی پیوندی
اوربیتال مولکولی پیوندی اوربیتال مولکولی است که در آن چگالی در ناحیه بین هستهها زیاد است. انرژی دو الکترون که در اوربیتال مولکولی پیوندی قرار میگیرند، کمتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
اوربیتال مولکولی ضد پیوندی
اوربیتال مولکولی ضد پیوندی اوربیتال مولکولی است که در آن چگالی الکترونی در ناحیه بین هستهها کم است. انرژی دو الکترون که در اوربیتال مولکولی ضد پیوندی قرار میگیرند، بیشتر از هنگامی است که در اوربیتال های اتمی به وجود آورنده آن، قرار گرفته باشند.
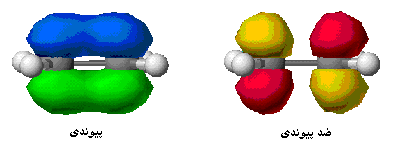
هر گاه دو اتم نتوانند به طریقی به هم نزدیک شوند که امکان همپوشانی اوربیتال های آن ها به وجود آید، همپوشانی اوربیتال ها صورت نمیگیرد و در نتیجه اوربیتال های اتمی به صورت غیر پیوندی در مولکول باقی خواهند ماند. اوربیتال های مولکولی را نیز با حروف یونانی 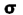 (سیگما) ،
(سیگما) ، 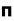 (پی) و ... نشانه گذاری میکنند.
(پی) و ... نشانه گذاری میکنند.
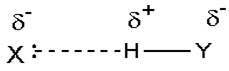
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اوربیتال مولکولی 2
اوربیتال های مولکولی سیگما
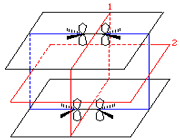
اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از محورها مثلاً x به صورت خطی در نظر بگیریم، دو اوربیتال اتمی (مثلا 1S) به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی سیگما و ضد پیوندی سیگما را به وجود میآورند. تمام اوربیتال های سیگما، نسبت به محور بین دو هسته کاملا متقارنند و چرخش مولکول به دور این محور ، تغییر قابل مشاهدهای در شکل اوربیتال بوجود نمیآورد.
نمودار تراز انرژی تشکیل اوربیتال های مولکولی 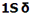 و
و 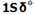 از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
از اوربیتال های اتمی 1S دو اتم به شکل زیر میباشد:
هر اوربیتال مولکولی میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن، دو الکترون (با اسپین های جفت شده) اوربیتال 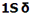 را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتالهای 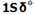
را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال 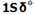 اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
اشغال نشده است. تعداد پیوند (مرتبه پیوند)، در هر مولکول عبارت است از نصف تفاضل الکترونهای ضد پیوندی از الکترونهای پیوندی.
برای H2 داریم:
1=2/(0-2) = مرتبه پیوند
در مورد ترکیب دو اتم هلیوم، باید مجموع چهار الکترون در دو اوربیتال مولکولی جای داده شوند. با جای دادن دو الکترون در اوربیتال 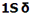 دو الکترون دیگر ناگزیر
دو الکترون دیگر ناگزیر 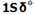 را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
را اشغال میکنند. از این رو مرتبه پیوند مولکول فرضی He2 عبارتست از:
0=(2-2)1/2=مرتبه پیوند
لذا هلیوم به صورت مولکولی He2 نمیتواند وجود داشته باشد. اثر جدا کننده الکترون های ضد پیوندی، اثر اتصال دهنده الکترون های پیوندی را خنثی می کند. شواهدی در دست است که نشان می دهد یون های مولکولی+ H2 و + He2 می توانند در شرایط ویژه ای وجود داشته باشند. ترکیب دو اوربیتال 2S ، اوربیتال های مولکولی و 2*S خ´ را بوجود میآورند که با اوربیتال های  و
و 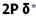 ناشی از ترکیب دو اوربیتال 1S مشابهند.
ناشی از ترکیب دو اوربیتال 1S مشابهند.

اما اوربیتال های مولکولی حاصل از ترکیب اوربیتال های اتمی 2P کمی پیچیدهترند. سه اوربیتال 2P هر اتم، در محورهای مختصات دکارتی z ، y ، x قرار دارند. اگر تشکیل یک مولکول دو اتمی از طریق نزدیک شدن سر به سر دو اوربیتال اتمی ( و یا ) صورت گیرد، در نتیجه همپوشانی، دو اوربیتال مولکولی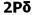 و
و 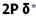 را بوجود میآورند .
را بوجود میآورند .
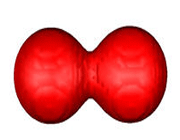
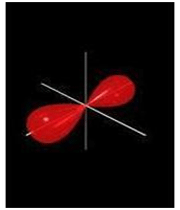
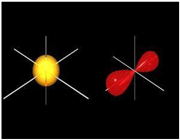
اوربیتال های مولکولی پی
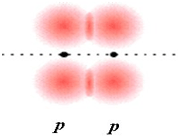
اگر در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (مثلا PZ) از پهلو بهم نزدیک شوند، دو اوربیتال مولکولی، یکی اوربیتال مولکولی پیوندی پی و دیگری اوربیتال مولکولی ضد پیوندی پی ستاره را بوجود میآورند.

اوربیتال های پای نسبت به محور بین دو هسته تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال P از پهلو، به تشکیل اوربیتال پای میانجامد، که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند. در هر حال اثر نهایی اوربیتال پای ، بهم نگهداشتن مولکول است. اوربیتال پای ستاره ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی مولکول پای ستاره جدا کردن دو اتم از یکدیگر است.
سطح انرژی اوربیتالهای مولکولی
انرژی یک اوربیتال مولکولی به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به انرژی اوربیتالهای اتمی تشکیل دهنده آن و همچنین به میزان و نوع همپوشانی اوربیتالهای اتمی که در تشکیل آن صورت میگیرد، بستگی دارد. به این ترتیب، انرژی هر دو اوربیتال مولکولی 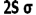 و
و 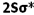 پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های
پایین تر از انرژی هر اوربیتال مولکولی است که اوربیتال های اتمی 2Pحاصل می شود. انرژی اوربیتال های 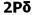 و
و 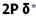 پایین تر از انرژی هر یک از دو اوربیتال
پایین تر از انرژی هر یک از دو اوربیتال 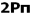 می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
می باشد. زیرا میزان همپوشانی اوربیتال های 2PX بیشتر از میزان همپوشانی 2PY و 2PZ می باشد.
در مولکولهایی که اوربیتالهای مولکولی 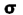 از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند
از همپوشانی بین یک اوربیتال Px و s حاصل میشود (تاثیر متقابل s-p)، این همپوشانی اضافی پیوند 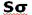 به ازای تضعیف پیوند
به ازای تضعیف پیوند 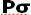 ، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال
، تقویت میشود و همچنین تاثیر متقابل s-p باعث کاهش انرژی اوربیتال 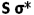 و افزایش انرژی
و افزایش انرژی 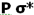 میشود. بنابراین سطح انرژی
میشود. بنابراین سطح انرژی 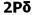 برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی
برای مولکولهای جور هسته متشکل از عناصر گروه دوم (به جز O2 و F2 ) پایین تر از سطح انرژی 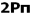 میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
میباشد. البته تاثیر متقابل s-p به میزان نزدیک تر انرژی اوربیتالهای p و s بستگی دارد. اگر تفاوت انرژی این دو اوربیتال خیلی زیاد باشد (مثل O2 و F2 ) این تاثیر اضافی مساله بوجود نمی آورد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
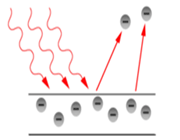
الکترونگاتیویته 1
الکترونگاتیویته میزان توانایی نسبی یک اتم در یک مولکول برای جذب جفت الکترون پیوندی به سوی خود است.
مقیاس نسبی پاولینگ
مقیاس نسبی الکترونگاتیوی پاولینگ، متداول ترین مقیاس و مبتنی بر مقادیر تجربی انرژیهای پیوندی است. مقدار انرژی اضافی که از جاذبه متقابل بارهای جزئی 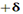 و
و 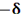 اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق
اضافه بر انرژی پیوند کووالانسی آزاد میشود، به قدر مطلق 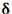 و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
و به تفاوت الکترونگاتیوی دو عنصر پیوند شده بستگی دارد.
در محاسبات الکترونگاتیوی تنها تفاوت الکترونگاتیویته عناصر تعیین میشود. برای بنا کردن یک مقیاس ، به اتم F (الکترونگاتیوترین عنصر) بطور دلخواه عدد 4 نسبت داده شده است.
مقیاس الکترونگاتیوی پائولینگ، متداولترین مقیاس و مبتنی بر مقادیر تجربی انرژی های پیوند است. مثلا انرژی پیوند Br-Br ،انرژی لازم برای تفکیک مولکول Br2 به اتم های Br است. برای تفکیک یک مول از مولکول های Br2 به اندازه 46+ کیلو کالری انرژی لازم است. انرژی پیوند H-H برابر 104+ کیلو کالری بر مول است.

الکترونگاتیویته به روش های متفاوتی تعریف شده است که برخی از آن ها به اختصار توضیح داده می شود.
الکترونگاتیویته پاولینگ
انرژی اضافی پیوند A-B نسبت به متوسط انرژی پیوندهای A-A و B-B می تواندبه حضور سهم یونی در پیوند کوالانسی نسبت داده شود. اگر انرژی پیوند A-B به طور قابل ملاحطه ای از متوسط پیوندهای غیر قطبی A-A و B-B متفاوت باشد میتوان فرض کرد که سهم یونی در تابع موج و بنابراین اختلاف بزرگ در الکترونگاتیوی وجود دارد.
الکترونگاتیویته آلرد - روکر
در این تعریف الکترونگاتیویته توسط میدان الکتریکی بر سطح اتم مشخص میشود. بنابرین الکترون در یک اتم بار موثر هستهای را احساس می کند. بر طبق این تعریف عناصری با الکترونگاتیویته بالا آن هایی هستند با بار هستهای موثر بزرگ و شعاع کوالانسی کوچک این عناصر در نزدیکی فلوئور قرار دارند.
الکترونگاتیویته مولیکن
مولیکن تعریف خود را بر پایه دادههای طیفهای اتمی نهاد. او فرض کرد که توریع دوباره الکترون در طی تشکیل ترکیب به گونهای است که در آن یک اتم به کاتیون (توسط ار دست دادن الکترون) و اتم دیگر به آنیون (توسط گرفتن الکترون) تبدیل میشود.
طیف هیدروژن
از طرف دیگر
این مشاهدات تعریف مولیکن را به عنوان مقدار متوسط انرژی یونش و الکترونخواهی عنصر معرفی می کند.
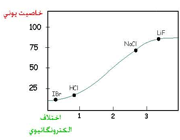
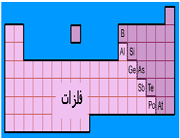
تغییرات الکترونگاتیویته عناصر
الکترونگاتیویته عناصر با افزایش تعداد الکترونهای والانس و هم چنین کاهش اندازه اتم افزایش مییابد و در هر دوره از جدول تناوبی از چپ به راست و در هر گروه از پایین به بالا افزایش مییابد.
فلزات، جاذبه کمی برای الکترونهای والانس دارند و الکترونگاتیوی آن ها حاکم است، ولی نا فلزات، به استثنای گازهای نجیب، جاذبه قوی برای اینگونه الکترونها دارند و الکترونگاتیوی آن ها زیاد است.
بنابراین، الکترونگاتیوترین عناصر، در گوشه بالایی سمت راست جدول تناوبی (بدون در نظر گرفتن گازهای نجیب) و عناصری که کمترین الکترونگاتیوی را دارند، در گوشه پایینی سمت چپ این جدول قرار دارند. این سیر تغییرات، با سیر تغییرات پتانسیل یونش و الکترونخواهی عناصر در جدول تناوبی هم جهت است
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
الکترونگاتیویته 2
مفهوم الکترونگاتیوی
مفهوم الکترونگاتیوی گرچه مفید است ولی دقیق نیست. روشی ساده و مستقیم برای اندازه گیری خاصیت الکترونگاتیویته وجود ندارد و روش های گوناگون برای اندازه گیری آن پیشنهاد شده است. در واقع چون این خاصیت علاوه بر ساختمان اتم مورد نظر به تعداد و ماهیت اتم های متصل به آن نیز بستگی دارد، الکترونگاتیوی یک اتم متغیر است. انتظار می رود که الکترونگاتیوی فسفر در PCl3 با الکترونگاتیوی آن در PCl5 تفاوت داشته باشد. از این رو این مفهوم را تنها بایستی نیمه کمی تلقی کرد.
PCl5

PCl3
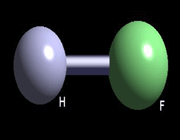
بنابراین میتوان گفت که قطبی بودن مولکول HCl ناشی از اختلاف بین الکترونگاتیوی کلر و هیدروژن است چون کلر الکترونگاتیوتر از هیدروژن است، آن سر مولکول که به کلر منتهی می شود، سر منفی دو قطبی است.
توجیه پیوند یونی با خاصیت الکترونگاتیویته
پیوند یونی بین غیرفلزات وقتی تشکیل میشود که اختلاف الکترونگاتیوی آن ها خیلی زیاد نباشد. در این گونه موارد اختلاف الکترونگاتیوی عناصر، نشان دهنده میزان قطبی بودن پیوندهای کووالانسی است.
هر چقدر اختلاف الکترونگاتیوی بیشتر باشد پیوند کووالانسی قطبیتر خوهد بود (پیوند در جهت اتم الکترونگاتیوتر قطبی میشود). بنابراین با توجه به مقادیر الکترونگاتیوی میتوان پیشگویی کرد که (HF) قطبیترین هیدروژن هالیدها است و انرژی پیوندی آن بیشتر از هر یک از این ترکیبات است. البته نوع پیوندی که بین دو فلز تشکیل می شود (پیوند فلزی) و در آن اختلاف الکترونگاتیوی نسبتا کم است.
مقدار الکترونگاتیوی HF
کاربردهای الکترو نگاتیویته
هرچه اختلاف الکترونگاتیوی دو عنصر بیشتر باشد، پیوند بین آنها قطبیتر خواهد بود. هرگاه اختلاف الکترونگاتیوی دو عنصر در حدود 7/1 باشد. خصلت یونی نسبی پیوند بیش از 50% است.
3. اگر اختلاف الکترونگاتیوی صفر و یا خیلی کوچک باشد، پیوند غیر قطبی است. هرچه اختلاف الکترونگاتیوی بیشتر باشد، پیوند کووالانسی قطبیتر خواهد بود. در این پیوندها، اتمی که الکترونگاتیوی بیشتری دارد، بار منفی جزئی را خواهد داشت.
4. با استفاده از مقادیر الکترونگاتیوی میتوان نوع پیوندی را که یک ترکیب ممکن است داشته باشد، پیشبینی کرد. وقتی دو عنصر با اختلاف الکترونگاتیوی زیاد با یکدیگر ترکیب می شوند، یک ترکیب یونی حاصل میشود. مثلا اختلاف الکترونگاتیوی سدیم و کلر 1/2 است و NaCl یک ترکیب یونی است.
آیا الکترونگاتیوی یک عنصر همیشه ثابت است؟
بنابراین الکترونگاتیوی یک عنصر همیشه ثابت نیست مثلا الکترونگاتیوی فسفر در ترکیب (PCl3) متفاوت از الکترونگاتیوی آن در ترکیب (PCl5) است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
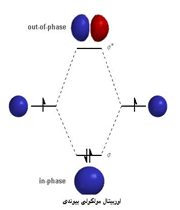
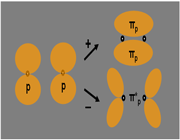
پیوند پای
اوربیتالهای مولکولی حاصل از ترکیب اوربیتالهای اتمی (2P)، کمی پیچیدهاند. سه اوربیتال (2P) هر اتم، در امتداد محورهای مختصات دکارتی (X ، Y ، Z ) قرار دارند. اگر تشکیل یک مولکول دو اتمی را از طریق نزدیک شدن اتم ها در امتداد یکی از این محورها مثلاً (X) در نظر بگیریم، دو اوربیتال اتمی (Px) سر به سر به یکدیگر نزدیک میشوند و در نتیجه همپوشانی، دو اوربیتال مولکولی پیوندی 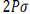 و ضد پیوندی
و ضد پیوندی 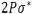 را به وجود میآورند.
را به وجود میآورند.
تعریف پیوند پی
پیوند کووالانسی که تراکم الکترونی آن در دو ناحیه بالا و پایین محور متصل کننده دو اتم پیوند بیشتر است، پیوند پی ( 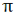 ) نامیده میشود.
) نامیده میشود.
اوربیتال پیوندی مولکولی پی ( 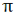 ) و ضد پیوندی (
) و ضد پیوندی ( 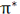 )
)
در تشکیل یک مولکول دو اتمی، دو اوربیتال اتمی (Pz) از پهلو به هم نزدیک میشوند و دو اوربیتال مولکولی، یکی اوربیتال پیوندی پی ( 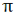 ) و دیگری اوربیتال مولکولی ضد پیوندی
) و دیگری اوربیتال مولکولی ضد پیوندی 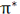 را به وجود میآورند.
را به وجود میآورند.
اوربیتالهای 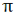 نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال
نسبت به محور بین دو هسته، تقارن استوانهای ندارند. نزدیک شدن دو اوربیتال (P) از پهلو ، به تشکیل اوربیتال 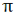 میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
میانجامد که متشکل از دو ناحیه تراکم بار الکترونی است. این تراکم بار الکترونی در ناحیه بالا و پایین محور بین دو هسته قرار دارند.
در هر حال اثر نهایی اوربیتال 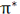 ، به هم نگه داشتن مولکول است. اوربیتال
، به هم نگه داشتن مولکول است. اوربیتال 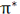 ، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال
، در ناحیه بین دو هسته، چگالی الکترونی کمی دارد. اثر نهایی اوربیتال 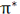 جدا کردن دو اتم از یکدیگر است.
جدا کردن دو اتم از یکدیگر است.
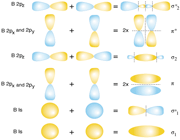
اوربیتالهای اتمی (Py) نیز از پهلو به هم نزدیک میشوند. این دو اوربیتال اتمی نیز یک مجموعه ی دوتایی اوربیتال مولکولی 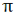 و
و 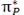 به وجود میآورند که نسبت به مجموعه اول عمود است.
به وجود میآورند که نسبت به مجموعه اول عمود است.
انرژی اوربیتالهای 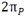 و
و 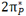
دو اوربیتال 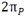 با یکدیگر و دو اوربیتال
با یکدیگر و دو اوربیتال 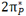 با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال
با یکدیگر هم انرژی هستند. بنابراین شش اوربیتال مولکولی از دو مجموعه سه تایی P به وجود میآید یک اوربیتال 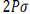 ، یک اوربیتال
، یک اوربیتال 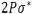 ، دو اوربیتال
، دو اوربیتال 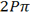 و دو اوربیتال
و دو اوربیتال  .
.
این شش اوربیتال به همراه دو اوربیتال از دو اوربیتال اتمی 2S ، مجموعا هشت اوربیتال مولکولی را تشکیل میدهند که از اوربیتالهای اتمی n=2 مربوط به دو اتم به دست میآیند.
تعریف انرژی اوربیتال مولکولی
انرژی یک اوربیتال مولکولی به موارد زیر بستگی دارد:
1. انرژی اوربیتالهای اتمی تشکیل دهنده آن
2. میزان و نوع همپوشانی اوربیتالهای اتمی در هنگام تشکیل آن
مقایسه انرژی 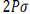 و
و 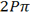
چون میزان همپوشانی اوربیتالهای 2P در تشکیل اوربیتال مولکولی 2P6 بیشتر از همپوشانی آن ها برای به وجود آوردن اوربیتال مولکولی 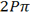 است، اوربیتال
است، اوربیتال 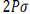 انرژی کمتری از دو اوربیتال مولکولی هم تراز
انرژی کمتری از دو اوربیتال مولکولی هم تراز 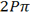 دارد.
دارد.
اوربیتالهای ضد پیوندی از هر نوع، همان قدر انرژی سیستم را افزایش می دهد که اوربیتال پیوندی از همان نوع، از انرژی سیستم میکاهد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
اختلال های رفتاری

به عبارت دیگر می توان گفت برای حل قسمت عمده ای از مسائلی که بشر امروز با آن روبرو است باید از علم روانشناسی کمک گرفت.
در همین راستا کتاب روان شناسی سال سوم رشته ادبیات و علوم انسانی بیش از یک دهه است که در چرخه ی آموزش کشور قرار دارد. مرکز یادگیری تبیان نیز به منظور یاری رساندن به شما دانش آموزان و دانشجویان عزیز، سلسله مقالاتی را در این ارتباط در نظر گرفته، که امید است مورد بهره مندیتان قرار گیرد.
جای تردید نیست که هر دستگاهی ممکن است اختلال کند، مثل هواپیما، کامپیوتر و... و بالطبع لازم می شود که دوباره تعمیر شوند. دستگاه عصبی مرکزی (مخ، نخاع و اعصاب) نیز اختلال پیدا می کند و این اختلال د رفتار منعکس می شود.
حال این اختلال رفتاری یا نابهنجاری رفتاری چیست؟
همانند بیش تر مفاهیم مربوط به انسان و مفاهیم مربوط به روان شناسی، تعریف رفتار نابهنجار و تعیین مرز آن با رفتار بهنجار، کاری بسیار دشوار و شاید هم غیر ممکن است. از نظر روان شناسان انسان بهنجار فردی است که:

بنابراین تعریف، هر فردی، کم و بیش بیمار (کم و بیش نابهنجار) خواهد بود. اما در واقع کسی که به شدت نابهنجار باشد، به طوری که نظم زندگی خود و دیگران را به هم بزند، مبادرت به خودکشی کند و همیشه اضطراب داشته باشد، فرد نابهنجار یا بیمار به حساب خواهد آمد.
اما اگر کسی به شغل شرافتمندانه ای اشتغال داشته باشد، به فکر سعادت خود و خانواده اش باشد و به حقوق دیگران احترام بگذارد و هدف اجتماع پسندی را دنبال کند، اضطراب، نگرانی، افسردگی یا شادی او متناسب با موقعیت باشد، بهنجار یا سالم به حساب خواهد آمد.
اختلال های اضطرابی
اختلال های اضطرابی نشانه های ذهنی و جسمی دارند.
در میان نشانه های ذهنی می توان به ترس از بدبختی، ترس از کنترل نداشتن بر خود، ناتوانی در راحت بودن و رفع خستگی اشاره کرد.
نشانه ی جسمی اضطراب عبارت است: از فعالیت شدید شاخه ی سمپاتیک دستگاه عصبی خودکار که با لرزش، عرق، سرعت و شدت تپش های قلبی، بالا رفتن فشار خون (سرخ شدن چهره) و سرگیجه همراه است.
می توان گفت که اضطراب، یک واکنش مناسب در مقابل تهدید است. با این همه، اگر گستردگی آن از حدود تهدید فراتر رود یا به طور کامل غیر قابل انتظار باشد، نابهنجار به حساب خواهد آمد. اختلال های اضطرابی، موارد زیر را شامل می شوند:
فوبی ها یا ترس های مرضی،
اختلال های وحشت زدگی،
اضطراب فراگیر، اختلال وسواس فکری –عملی و
استرس پس- آسیبی.
اختلال های خلقی
اختلال های خلقی به اختلال هایی گفته می شود که با آشوب ها و دگرگونی های شدید هیجانی همراه هستند. آشوب های هیجانی معمولا از طریق افسردگی یا برانگیختگی بیش از اندازه منعکس می شوند.
البته نباید فراموش کرد که، در بیشتر مواقع، افسردگی و برانگیختگی عادی است، مثلا، اگر در امتحان مردود شویم خیلی طبیعی خواهد بود که احساس افسردگی کنیم، یا اگر یکی از نزدیکان خود را از دست بدهیم، به شدت افسرده خواهیم بود و این کاملا طبیعی است.
اضطراب و افسردگی زمانی اختلال به حساب می آیند که اغراق آمیز باشند. مثلا، چند سال پس از فوت یکی از عزیزان، همچنان افسرده باشیم.
افسردگی یکی از اختلال های روانی بسیار شایع است که آن را، از نظر روانی به ذکام تشبیه می کنند. اشخاصی که از افسردگی عادی رنج می برند، ممکن است احساس غم کنند و افکار مالیخولیایی داشته باشند. احتمال دارد که آن ها از کمبود انرژی، افت اعتماد به نفس، دشواری در تمرکز، عدم علاقه به دیگران و فعالیت های خوشایند، احساس بدبینی و تمایل به گریه کردن و افکار منجر به خودکشی رنج ببرند.
اشخاص مبتلا به افسردگی شدید نیز معمولا همه ی احساسات بالا را نشان می دهند، با این تفاوت که شدت احساسات آن ها به ظاهر خیلی شدید است. به علاوه، احتمال دارد که آن ها اشتها و مقداری از وزن خود را از دست بدهند، تمرکز نداشته باشند، به بی اعتنایی عمومی و تلاش برای خودکشی گرفتار شوند.
نقطه ی مقابل افسردگی، سرخوشی یا شیدایی است. افراد سرخوش یا مانیک، به شدت برانگیخته می شوند، حرکات ابلهانه انجام می دهند و اشیا و لوازم را تخریب می کنند. این افراد به طور تکانشی رفتار می کنند، تند حرف می زنند، تسلسل افکار دارند، از محدوده ی خود خارج می شوند، به طور انفحاری می خندند، روی پا بند نمی شوند، دیگران را مسخره می کنند و...
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
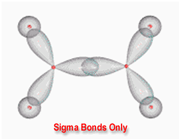
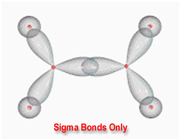
پیوند سیگما
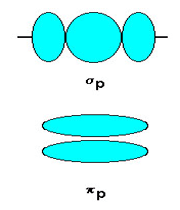
اوربیتال S به شکل کره است و مرکز آن در هسته اتم قرار دارد. برای تشکیل پیوند، دو هسته باید به اندازه کافی به یکدیگر نزدیک شوند تا همپوشانی مولکول های اوربیتالهای اتمی صورت پذیرد.
نشان دادن اوربیتالهای اتمی با حروف (P , S , ...) مرسوم است. اوبیتالهای مولکولی نیز با حروف یونانی (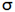 ) سیگما،
) سیگما،
(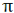 ) (پی) و غیره نشانه گذاری میشوند.
) (پی) و غیره نشانه گذاری میشوند.
تشکیل پیوند سیگما
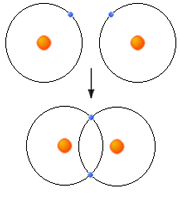
اوربیتالهای مولکولی (H2)، از همپوشانی دو اوربیتال (S) از دو اتم هیدروژن حاصل شدهاند. اگر همپوشانی طوری بین دو اوربیتال صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تقویت کنند، چگالی الکترونی در ناحیه بین دو هسته زیاد خواهد بود و جاذبه دو هسته با بار مثبت نسبت به ابر الکترونی اضافه با بار منفی، مولکول را به هم نگه میدارد و مولکول پایدارتر از اتمهای هیدروژن میشود. اوربیتالهای پیوندی یا اوربیتال مولکولی حاصل، اوربیتالهای سیگما و این پیوندها را پیوندهای سیگما مینامند و با نماد (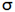 ) نشان داده میدهند.
) نشان داده میدهند.
تشکیل اوربیتال ضد پیوندی سیگما
چون دو اوربیتال اتمی با یکدیگر ترکیب شدهاند، باید دو اوربیتال مولکولی به دست آید. اوربیتال مولکولی دیگر، وقتی حاصل می شود که همپوشانی بین دو اروبیتال اتمی طوری صورت پذیرد که ابر الکترونی بین دو هسته، همدیگر را تضعیف کنند.
در این حالت چگالی الکترونی در ناحیه بین دو هسته خیلی کم است.
چون دو هسته ی مثبت همدیگر را دفع میکنند و در فاصله بین آن ها، چگالی کم الکترونی قادر به جبران این دافعه با ایجاد جاذبهای قوی نیست، لذا نزدیک نگاه داشتن دو هسته در این حالت نیازمند انرژی است. این اوربیتال مولکولی را اوربیتال ضد پیوندی سیگما ( با نشان 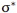 ) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
) مینامند. چون نه تنها در به هم نگه داشتن دو اتم کمک نمیکند بلکه عمل آن در جهت دور کردن دو اتم از یکدیگر است.
تقارن اوربیتالهای سیگما
اوربیتالهای سیگما (پیوندی و غیرپیوندی)، به دور محوری که دو هسته را به یکدیگر متصل میکند، تقارن استوانهای دارند و چرخش مولکول دور این محور، تغییر قابل مشاهدهای در شکل اوربیتال به وجود نمیآورد.
انرژی اوربیتال پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند کمتر است، در حالی که انرژی اوربیتال ضد پیوندی سیگما از انرژی هر یک از اوبیتالهای اتمی که آن را به وجود آوردهاند بالاتر است.
وقتی دو اوربیتال اتمی ترکیب میشوند:
اوربیتال مولکولی پیوندی نشان دهنده کاهش انرژی سیستم و اوربیتال مولکولی ضد پیوندی نشان دهنده افزایش انرژی سیستم است
مرتبه پیوند
هر اوربیتال ( اتمی یا مولکولی ) میتواند دو الکترون با اسپین مخالف را در خود جای دهد. در مولکول هیدروژن دو الکترون ( با اسپینهای جفت شده ) اوربیتال ( 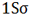 ) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (
) را که اوربیتالی در دسترس با حداقل انرژی است اشغال میکنند. اوربیتال (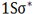 ) اشغال شده است.
) اشغال شده است.
تعداد پیوند یا مرتبه پیوند در هر مولکول عبارت است از نصف الکترون های ضد پیوندی از الکترون های پیوندی است.
مرتبه پیوند برای (H2) برابر 1 و برای (He) صفر است.
بررسی اوربیتال (2S)
ترکیب دو اوربیتال (2S)، اوربیتالهای مولکولی (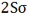 ) و (
) و ( 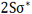 ) را به وجود میآورد که با اوربیتالهای (
) را به وجود میآورد که با اوربیتالهای (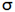 ) و (
) و ( 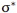 ) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
) ناشی از ترکیب دو اوربیتال (1S) مشابه اند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
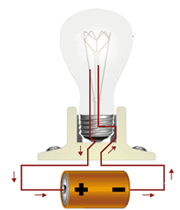
پیوند فلزی
تعریف پیوند فلزی
بین اتم های فلز در شبکه بلور پیوند ویژهای وجود دارد که در اصطلاح پیوند فلزی نامیده میشود.
توجیه پیوند فلزی
انرژی یونش فلزات نسبت به غیر فلزات نسبتا کمتر و تعداد اوربیتال های خالی لایه ظرفیت اتم آن ها نسبت به تعداد الکترون های لایه ظرفیت نیز کم است. از این رو، تعدادی از الکترون های سست لایه ظرفیت اتم فلز که در اصطلاح دریای الکترون فلزی نیز نامیده میشوند، باقیمانده اتم های فلز را که دارای بارمثبت خواهند بود، فرا میگیرد. جاذبه الکتروستاتیکی بین این ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد فلزی به وجود می آید که سرتاسر شبکه بلور فلز را گرفته است.
پیوند فلزی
جاذبه الکتروستاتیکی حاصل بین ذرههای مثبت فلزی و بارمنفی توده ابر الکترونی آزاد، عامل پیوند بین ذرههای فلز محسوب میشود و اتصال ذرههای فلز را در شبکه و انسجام بلور فلزی را تأمین میکند. چون چنین پیوندی دارای جهت خاصی نیست و ذرههای فلز نیز امکان جابجا شدن در داخل توده ابر الکترون آزاد فلزی را در شبکه بلور دارند، از این رو، به روشنی میتوان بسیاری ازخواص ویژه مکانیکی فلزها، مانند قابلیت چکش خواری، مفتول شدن، تورق و غیره را توجیه کرد.
توجیه خواص فلزات با پیوند فلزی
1. رسانایی الکتریکی
جریان برق نتیجه جابجایی الکترون است. وقتی دو سر سیم برق رابه یک تکه فلز متصل کنیم از قطب مثبت جریان تعدادی الکترون از فلز خارج میشود، این کمبود الکترونی بر الکترون های غیرمستقر در فلزات اثر گذاشته، آن ها را به سمت خود میکشند. این امر باعث میشود که همان تعداد الکترون که از یک طرف خارج شده بود از طرف دیگر وارد شود و به این وسیله جریان الکتریسته انتقال یابد.
2. رسانایی گرمایی
بر اثر گرم کردن فلز، جنبش الکترون های غیر مستقر افزایش مییابد و این جنبش از یک گوشه فلز به سایر قسمت های آن منتقل میشود.
3. درخشندگی و جلای فلزات
تابش نور به سطح فلز باعث میشود که الکترون های غیر مستقر در سطح فلز برانگیخته شده و به ترازهای بالاتر انرژی بروند. بازگشت این الکترون ها باعث میشود که امواج نور مرئی از سطح فلز بازتابیده شود. در مورد فلزات رنگین بازگشت الکترون ها تنها طول موج معینی را که مربوط به رنگ فلز است بازتاب میکند.
4. پدیدههای فوتوالکتریک و ترموالکتریک
وقتی انرژی کافی (نورانی یا گرمایی) به فلز داده شود برانگیخته شدن الکترون بدان حد میرسد که الکترون از فلز جدا شود. هرگاه دستگاه مناسبی فراهم کنیم میتوانیم الکنرون جدا شده را درمدار به جریان در آورده الکتریسته تولید کنیم.
5. چکش خواری
وقتی ضربهای به فلز وارد میشود یون های مثبت در دریای الکترون منفی جابجا میشوند ولی دریای بار منفی پیوستگی تکه فلز را حفظ میکند.
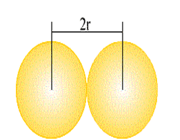
طول و شعاع پیوند فلزی
در مورد فلزها اصطلاح طول پیوند فلزی، به فاصله تعادلی بین هسته دو اتم مجاور در شبکه بلور فلزها اطلاق میشود. بر حسب قرار داد نصف طول پیوند فلزی را شعاع فلزی مینامند که گاهی شعاع اتمی فلز نیز نامیده میشود.
باید توجه داشت که شعاع فلزی به سیستم بلوری فلز وابستگی دارد. یعنی اگر فلزی در چند سیستم متمایز متبلور شود شعاع فلزی آن در سیستم های گوناگون یکسان نخواهد بود. بررسیها و محاسبهها نشان داده است که هرچقدر عدد کوئوردیناسیون اتم فلز در شبکه بلور بزرگ تر باشد طول شعاع فلزی آن افزایش می یابد.
با توجه به این که در پیوند فلزی بر خلاف پیوند کوالانسی همپوشانی بین اوربیتال های دو اتم صورت نمیگیرد، انتظار میرود که طول پیوند کوالانسی آن بیش تر باشد که تجربه نیز چنین رویدادی را تأیید میکند. بدیهی است که شعاع فلزی نیز از شعاع کوالانسی بزرگتر است.
شعاع اتمی فلز قلیایی در هر دوره نسبت به شعاع اتمی عنصرهای دیگر آن دوره به نسبت بزرگتر است
پس از فلزات قلیایی خاکی در هر دوره بویژه از دوره چهارم به بعد اندازه شعاع اتمی به شدت کاهش مییابد.
این کاهش شدید اندازه شعاع را باید از یک طرف به بالا بودن سطح تراز S لایه ظرفیت اتم عنصرهای قلیایی خاکی و قلیایی و پایین بودن سطح تراز d لایه ظرفیت فلزات واسطه و گسترده بودن اوربیتال های d در این عنصر مثبت داد. زیرا به دلیل عمقی و گسترده بودن اوربیتال های d، ابر بار الکترون ها در آن ها گسترده است و اثر پوششی ناچیزی در مقابل تأثیر بار هسته اتم برلایه خارجی اتم اعمال میکنند.
از این رو بر اثر بالا رفتن بیش ازحد انتظار مقدار بار مۆثر هسته اتم فلزهای واسطه اندازه شعاع آن ها به شدت کاهش مییابد.
روند تغییر اندازه شعاعها در مورد فلزهای واسطه هر دوره جالب توجه و برخلاف روند عادی آن در مورد تغییر شعاع عنصرهای اصلی در دوره هاست. البته این روند به وضعیت الکترونی ویژه آن ها بستگی دارد. با توجه به قابلیت انعطاف و تغییر شکل ناپذیری که نتیجه قابلیت تحرک پیوند فلزی است انتظار میرود که قدرت پیوند بین دو اتم فلز در بلور فلزی از قدرت پیوند کوالانسی بین دو اتم آن در حالت گازی کم تر باشد.
انرژی پیوند فلزی
اندازه گیری گرمای تفکیک نشان میدهد که انرژی مولی پیوند فلزی در شبکه بلوری از انرژی مولی تفکیک پیوند کوالانسی آن به صورت مولکول دو اتمی بیش تر است. این رویداد را این طور میتوان توجیه کرد که پیوند فلزی به تعداد نامحدود در تمام راستا در شبکه بلور فلزی تشکیل میشود در صورتی که چنین وضعیتی در حالت گازی فلزها وجود ندارد.
از این رو با وجود این که بلور فلزی پیوستگی و پایداری زیادی دارد و پیوند فلزی در مجموع پیوندی قوی محسوب میشود. بدیهی است در هر گروه با افزایش عدد اتمی و بزرگ تر شدن طول پیوند فلزی انرژی پیوند و گرمای تفکیک مولی فلز کاهش می یابد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
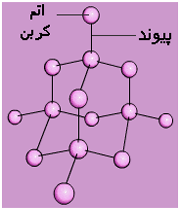
پیوند کووالانسی
میلیونها ماده مرکب شناخته شده فقط از غیر فلزات ترکیب یافتهاند. این مواد مرکب فقط شامل عناصری هستند که در هر اتم 4 ، 5 ، 6 یا 7 الکترون والانس دارند. بنابراین الکترونهای والانس اتمهای غیر فلزی آنقدر زیاد است که اتمها نمیتوانند با از دست دادن آن ها ساختار یک گاز نجیب را به دست آورند. معمولا غیر فلزات با جفت کردن الکترونها پیوند ایجاد میکنند و در این فرآیند به ساختار یک گاز نجیب میرسند.
تعریف پیوند کووالانسی
یک جفت الکترون مشترک بین دو هسته یک پیوند کووالانسی تشکیل میدهند.
استحکام پیوند کووالانسی
آنچه اتمهای یک ملکول را به هم نگه میدارد، پیوند کووالانسی است، در تشکیل پیوند کووالانسی الکترونها، به جای آنکه از اتمی به اتم دیگر منتقل شوند، میان دو اتم به اشتراک گذاشته میشوند.استحکام پیوند کووالانسی ناشی از جاذبه متفابل دو هسته مثبت و ابر منفی الکترونهای پیوندی است. یا به عبارت دیگر مربوط به آن است که هر دو هسته الکترون های مشترکی را جذب میکنند.

دو اوربیتال به نحوی همپوشانی میکنند که ابرهای الکترونی، در ناحیه بین دو هسته، یکدیگر را تقویت میکنند و احتمال یافتن الکترون در این ناحیه افزایش مییابد طبق اصل طرد پاولی دو الکترون این پیوند باید اسپین مخالف داشته باشند. در نتیجه تشکیل پیوند اوربیتالهای اتمی به اوربیتال مولکولی تبدیل میشود.
انواع پیوند کووالانسی
پیوند یگانه کووالانسی
متشکل از یک جفت الکترون (دارای اسپین مخالف) است که اوربیتالی از هر دو اتم پیوند شده را اشغال میکند. سادهترین نمونه اشتراک در مولکولهای دو اتمی گازهای ازقبیل F2 ، H2 و Cl2 دیده میشود. اتم هیدروژن فقط یک الکترون دارد هرگاه دو اتم هیدروژن تک الکترونهای خود را به اشتراک بگذارند یک جفت الکترون حاصل میشود.

پیوند چند گانه
بین دو اتم ممکن است بیش از یک پیوند کووالانسی تشکیل شود در این موارد گفته میشود که اتمها با پیوند چند گانه به هم متصلاند. دو جفت الکترون مشترک را پیوند دو گانه و سه جفت الکترون مشترک را پیوند سه گانه مینامند. اغلب میتوان تعداد پیوندهای جفت الکترونی را که یک اتم در یک مولکول به وجود میآورد از تعداد الکترونهای مورد نیاز برای پر شدن پوسته والانس آن اتم پیش بینی کرد.

نماد ساختار مولکول
در ساختار اول، جفت الکترون مشترک با دو نقطه و ساختار دوم با یک خط کوتاه نشان داده شده است.
مانند :
پیوند یگانه
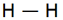
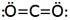
پیوند سه گانه
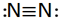


موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
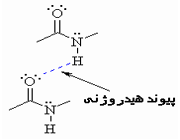
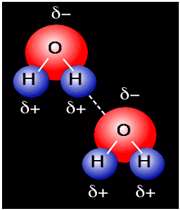
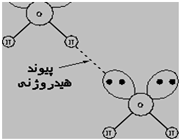
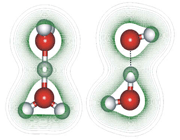
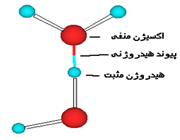
پیوند هیدروژنی
جاذبه بین مولکولی دربرخی از ترکیبات هیدروژندار به طور غیرعادی قوی است این جاذبه در ترکیباتی مشاهده میشود که درآن ها بین هیدروژن و عناصری که اندازه کوچک و الکترونگاتیوی زیاد دارند پیوند هیدروژنی وجود دارد. پیوند هیدروژنی نه تنها بین مولکول های یک نوع ماده، بلکه بین مولکول های دو ماده متفاوت که توانایی تشکیل پیوند هیدروژنی را دارند نیز برقرار میشود.
تعریف پیوند هیدروژنی Hydrogen Bond
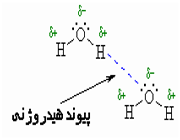
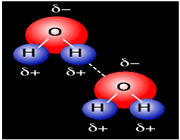
هرگاه هیدروژن به اتمی با الکترونگاتیوی زیاد مثل فلوئور، اکسیژن یا نیتروژن متصل گردد، شرایطی برای به وجود آمدن نوع بسیاری مهمی جاذبه بین مولکولی مثبت ـ منفی حاصل میشودکه به آن پیوند هیدروژنی میگویند.
به عبارت دیگر، اتم یک مولکول هیدروژن و زوج الکترون غیر مشترک مولکول دیگر متقابلا همدیگر را جذب میکنند و پیوندی تشکیل میشود که به پیوند هیدروژنی مرسوم است.
نحوه تشکیل پیوند هیدروژنی
پیوند هیدروژنی بر اثر جاذبه اتم هیدروژن اندک مثبت موجود در یک مولکول و اتم بسیار الکترونگاتیو موجود در مولکول دیگر (یا در محل دیگر همان مولکول اگر مولکول به قدر کافی بزرگ باشد که بتواند روی خود خم شود) تولید میگردد.
جا به جا شدن یک جفت الکترون به سمت عنصر بسیار الکترونگاتیو نیتروژن، اکسیژن یا فلوئور باعث میشود که این اتم ها دارای بار منفی جزئی شوند. در این صورت پیوند هیدروژنی پلی است میان دو اتم شدیدا الکترونگاتیو با یک اتم هیدروژن که از طرفی به طور کوالانسی با یکی از اتم های الکترونگاتیو و از طرف دیگر بطور الکترواستاتیکی (جاذبه مثبت به منفی) با اتم الکترونگاتیو دیگر پیوند یافته است.
استحکام پیوند هیدروژنی یک دهم تا یک پنجاهم قدرت یک پیوند کوالانسی متوسط است.
شرایط تشکیل پیوند هیدروژنی
1. بالا بودن الکترونگاتیوی اتم های متصل به هیدروژن
برهمین اساس است که فلوئور (الکترونگاتیوترین عنصر) قویترین پیوند هیدروژنی را تشکیل می دهد و اکسیژن (الکترونگاتیوتر از نیتروژن) پیوند هیدروژنی قویتری درمقایسه با نیتروژن تشکیل میدهد.
هم چنین بار مثبت زیاد بر روی اتم هیدروژن، زوج الکترون مولکول دیگر را به شدت جذب میکند و کوچک بودن اندازه اتم هیدروژن سبب میشود که ملکول دوم بتواند به آن نزدیک شود.
2. کوچک بودن اتم های متصل به هیدروژن
پیوند هیدروژنی واقعا مۆثر فقط در ترکیبات فلوئور، اکسیژن و نیتروژن تشکیل میشود. با وجود این که دو اتم نیتروژن و کلر الکترونگاتیوی برابر دارند چون اتم کلر از اتم نیتروژن بزرگ تر است بر خلاف نیتروژن، کلر پیوند هیدروژنی ضعیفی تشکیل میدهد.
توجیه خواص غیرعادی برخی از مواد
وجود خواص غیرعادی برخی از مواد در حالت جامد یا مایع از جمله بالا بودن دماهای ذوب و جوش، نشان میدهد که نیروهای جاذبه بین مولکولی در آن ها به اندازهای زیاد است که نمیتوان آن را به تأثیرهای متقابل ضعیف بین مولکولی نسبت داد. آشناترین این نوع مواد فلوئورید هیدروژن، آب و آمونیاک است که بسیاری از خواص آن ها از جمله دماهای جوش و ذوب آن ها از دماهای جوش و ذوب ترکیب های مشابه خود به طور غیرمنتظرهای بالاتر است.
شاید تصور شود که علت این وضعیت غیر عادی، قطبیت به نسبت زیاد این مولکول هاست؛ البته تا اندازهای همین طور است، اما بررسی دقیق این پدیده غیر عادی نشان میدهد که باید نیروی جاذبه قوی تر از نیروهای جاذبه دوقطبی _ دوقطبی بین مولکول های آن ها برقرار باشد.
اگر به ساختار الکترونی مولکولی آن ها توجه شود، میتوان به موردهای مشترک بین آن ها پی برد:
این وجه اشتراک، وجود دست کم یک پیوند کوالانسی با اتم هیدروژن و یک اوربیتال هیبریدی ناپیوندی دو الکترونی اتم مرکزی بسیار الکترونگاتیو در هر یک از آن هاست
اتم هایی که الکترونگاتیوی بالایی دارند با هیدروژن پیوند کوالانسی به شدت قطبی به وجود میآورند به طوری که هیدروژن به میزان قابل توجهی خصلت یک پروتون را پیدا میکند.
جفت الکترون ناپیوندی و قابل واگذاری روی اتم H، این امکان را پدید میآورد که اتم هیدروژن در نقش پل، اتمهای الکترونگاتیو دو مولکول را به یکدیگر متصل کند و نیروی جاذبه بین مولکولی بوجود میآید که به پیوند هیدروژنی مرسوم است.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
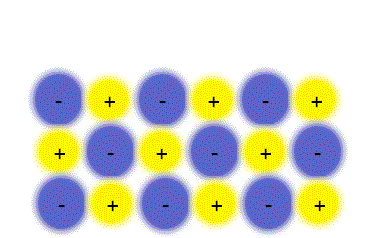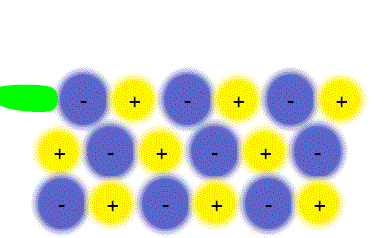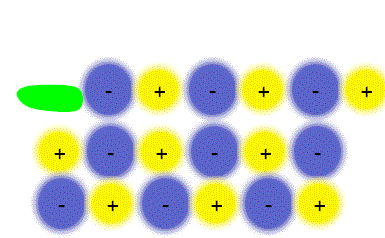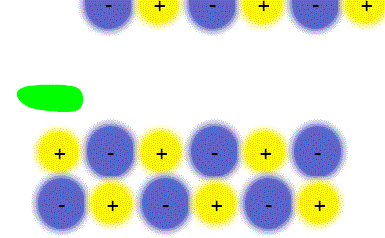
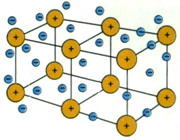
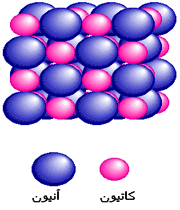
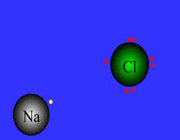
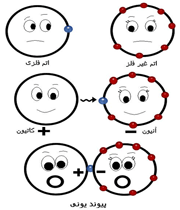
پیوند یونی
ترکیبات یونی که متشکل از تعداد زیادی آنیون و کاتیون هستند با طرح معین هندسی در کنار هم قرار گرفتهاند و یک بلور را به وجود میآورند. هر بلور به سبب جاذبههای منفی ـ مثبت یون ها به هم نگهداشته شده است. فرمول شیمیایی یک ترکیب یونی نشانه سادهترین نسبت یون های مختلف برای به وجود آوردن بلوری است که از نظر الکتریکی خنثی باشد.
تعریف پیوند یونی IonicBond
پیوند یونی جاذبهای است که بین یون های مثبت و منفی وجود دارد و آن ها را در یک ساختار بلورین به هم نگه میدارد. این پیوند ناشی از انتقال الکترون بین اتم هاست.
ماهیت یون
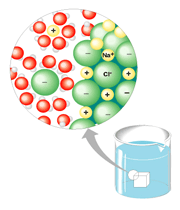
وقتی اتمها به یون تبدیل میشوند خواص آن ها شدیدا تغییر می کند مثلا مجموعهای از مولکول های برم قرمز است، اما یون ها در رنگ بلور ماده مرکب هیچ دخالتی ندارند. یک قطعه سدیم شامل اتمهای سدیم نرم است خواص فلزی دارد و بر آب به شدت اثر میکند اما یون های آن در آب پایدارند.
به همین لحاظ است که یون های سدیم و کلر را به صورت نمک طعام میتوان بدون ترس از واکنش شدید روی گوجه فرنگی ریخت. وقتی اتمها به صورت یون در میآیند ماهیت آن ها آشکارا تغییر میکند.
خواص مواد مرکب یونی
1. رسانایی الکتریکی
رسانایی الکتریکی مواد مرکب یونی مذاب به این علت است که وقتی قطبهایی با بار مخالف در این مواد مذاب قرار گیرد و میدان الکتریکی برقرارشود یون ها آزادانه به حرکت در میآیند این حرکت یون ها بار یا جریان را از یک جا به جای دیگر منتقل میکنند. در جسم جامد که یون ها بیحرکتاند و نمیتوانند آزادانه حرکت کنند جسم خاصیت رسانای الکتریکی ندارد.
2. سختی
سختی مواد مرکب یونی به علت پیوند محکم میان یون های با بار مخالف است. برای پیوندهای قوی انرژی بسیاری لازم است تا یونها از هم جدا شوند و امکان حرکت آزاد حالت مذاب را پیداکنند. انرژی زیاد به معنی نقطه جوش بالا است که خود از ویژگیهای مواد مرکب یونی است.
3. شکنندگی
مواد مرکب یونی شکنندهاند. زیرا ساختار جامد آن ها آرایه منظمی از یون هاست. مثلا ساختار سدیم کلرید (NaCl) را در نظر بگیرید. هرگاه یک سطح از یون ها فقط به فاصله یک یون در هر جهت جابجا شود یون هایی که بار مشابه دارند درکنار یکدیگر قرار میگیرند و یکدیگر را دفع میکنند و چون جاذبهای در کار نیست بلور میشکند. سدیم کلرید را نمیتوان با چکش کاری به ورقههای نازک تبدیل کرد با چنین عملی بلور نمک خرد و از هم پاشیده میشود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
انتقال انرژی گرمایی
خورشید منبع انرژی کره ما زمین است . انرژی خورشید به درون فضا ، اتمسفر و سطح زمین منتقل میشود . از آنجائی که این انرژی سطح زمین و اتمسفر را گرم می کند مقداری از آن به انرژی گرمایی تبدیل می شود . برای انتقال گرما به درون اتمسفر سه روش وجود دارد :
*تابش *هدایت * انتقال
تابش
اگر در کنار آتش و یا شومینه ای بایستید انتقال گرما به خودتان را متوجه می شوید که به آن تابش می گوییم. طرفی از شما که به سمت آتش قرار گرفته است گرم می شود در حالی که سمت دیگر که از آتش دور است بی تاثیر از حرارت باقی می ماند . اگرچه هوا شما را احاطه کرده است ولی هیچ نقشی در انتقال این گرما ندارد . چراغ های حرارتی از این روش برای گرم نگه داشتن غذا استفاده می کنند. انتقال انرژی گرمایی در درون فضا توسط تابش های الکترومغناطیسی صورت می گیرد که به این عمل تابش گفته می شود.
بیشتر تابش های الکترومغناطیسی که از طریق خورشید به زمین می رسد به شکل نور مشاهده می شوند. نور از امواجی با فرکانس های مختلف تشکیل شده است. یک فرکانس عبارت است از دفعاتی که یک اتفاق در زمانی خاص تکرار می شود . در تابش های الکترومغناطیسی، فرکانس به دفعاتی که یک موج از یک نقطه در یک ثانیه می گذرد ، گفته می شود .
ذهن ما این فرکانس های مختلف را به شکل تفسیری از رنگ ها مثل قرمز ، نارنجی ، زرد ،سبز ،نیلی و بنفش در می آورد . هنگامی که چشم همه این رنگ ها را به طور همزمان ببیند آن را به رنگ سفید تفسیر می کند . امواجی که از سوی خورشید می آیند و ما آن ها را نمی توانیم ببینیم ر ا مادون قرمز می نامند .این امواج دارای فرکانس هایی پایین تر از قرمز می باشند. امواج ماورا بنفش نیز دارای فرکانس هایی بالاتر از بنفش هستند .

بسیاری از تابش های خورشیدی که به سطح زمین تابیده می شود توسط اتمسفر جذب می شود که حجم بیشتری از این تابش ها از سطح زمین به اتمسفر بازتاب می شود تا به صورت انرژی گرمایی دربیاید. اجسام به رنگ تیره مثل آسفالت کف خیابان انرژی پرتویی بیشتری را جذب می کنند و زودتر از اجسام با رنگ روشن گرم می شوند . همچنین اجسام با رنگ تیره انرژی موجود در خودشان را سریع تر ازاجسام با رنگ روشن تابش می کنند.
هدایت گرما
به جابه جایی انرژی گرمایی ازیک ماده به ماده دیگر ویا درون یک ماده را هدایت گرما می نامیم. آیا هرگز یک قاشق فلزی را در کنار ظرف سوپی که هنوز بر روی اجاق گاز است گذاشته اید؟ بعد از زمانی کوتاه دسته قاشق داغ خواهد شد. این اتفاق در نتیجه انتقال انرژی از یک مولکول به مولکول دیگر ویا یک اتم به اتم دیگر صورت می گیرد. همچنین هنگامی که اجسام در تماس با یگدیگر قرار دارند فلز از طریق انتقال انرژی گرم می شود.(نارنجی / قرمز برافروخته ). به این امر هدایت گرمایی گفته می شود که یکی از راه های موثر در انتقال انرژی در فلزات است. لازم به ذکر است که عمل هدایت گرمایی در هوا بسیار ضعیف انجام می گیرد.

انتقال
به جابه جایی انرژی گرمایی در مایعات انتقال گفته می شود .در آشپزخانه هنگامی که یک مایع در حال جوشیدن است می توان این نوع گرما را مشاهده کرد. هوا در درون اتمسفر همانند یک سیال عمل می کند . وقتی تابش های خورشید با زمین برخورد می کنند سنگ ها را گرم می کنند . همچنان که دمای سنگ در اثر هدایت گرمایی زیاد شد انرژی گرمایی به صورت حبابی از هوا که گرمتر از هوای اطراف سنگ است وارد اتمسفر میشود. حباب هوا هم چنان که به سمت اتمسفر بالا می رود شروع به سرد شدن می کند.

همچنان که این توده گرم بالا می رود با هوای اطرافش که سردتر است جابه جا می شود و به این ترتیب هوایی با غلظت بیشتر ایجاد شده ، که این همان چیزی است که ما آن را باد می نامیم.
این جابه جایی توده های هوا دربعضی مناطق بسیار کم است. مثل ابرهای محلی کیومولوس ویا چرخه های وسیع در تروپوسفر که بخش بزرگی از زمین را پوشش می دهند. در تروپوسفر، بسیاری از قالب های هوایی از طریق جریان انتقال ایجاد می شوند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:

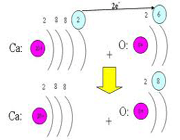
عناصر گروه دوم در جدول تناوبی (فلزات قلیایی خاکی) هریک دو الکترون والانس دارند. پس برای این که mg ، ca ، sr ، ba ساختار گاز نجیب را به دست آورند اتمهای هرعنصر باید دو الکترون از دست بدهند.
از دست رفتن دو الکترون موجب میشود که، دو پروتون در هسته خنثی نشده بماند. پس هر یون بار +2 خواهد داشت. برای جدا شدن سومین الکترون لازم است جفت الکترون های تراز اصلی با انرژی پایینتر شکسته شود. این امر انرژیِ زیادتری میخواهد. جداشدن الکترون ها از فلزات و تشکیل یون های مثبت حاصل از آن ها را میتوان به راه های مختلف ترسیم کرد.
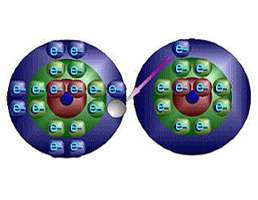
پس از جدا شدن یک الکترون از یک اتم معین، جداشدن الکترون های بعدی به ترتیب مشکل تر میشود. زیرا با از دست رفتن هر الکترون، بار مۆثر هسته زیادتر میشود و هسته، الکترون های باقیمانده را محکم تر نگاه میدارد. به طور خلاصه، یون های مثبت وقتی تشکیل میشوند که اتمهای فلزی یک الکترون (گروهIA ) دو الکترون (گروهIIA) و یا سه الکترون (گروهIIIA) به اتمهای غیر فلزی میدهند. یون های حاصل آرایش الکترونی یکسان با یک گاز نجیب دارند.
هالوژن ها
یون های مثبت، در حضور یون های منفی پایدار میشوند. خنثی شدن بار، هر دو نوع یون را پایدار میکند. یون های منفی پایدار، از اتمهایی که شش الکترون والانس دارند و هر یک، یک الکترون میخواهند تا به آرایش الکترونی هفت الکترون والانس برسند، تولید میشوند.
این گونه اتمها آن قدر الکترون بدست میآورند تا ساختار گاز نجیب را پیدا کنند. مثلا اتمهای عناصر گروه VIIA (هالوژنها) هفت آرایش یک گاز نجیب را پیدا می کنند. اگر اتمهای F ، Cl ، Br ، I هر یک، یک الکترون به دست آورند، یون های حاصل به ترتیب آرایش الکترونی گاز های نجیب را خواهند داشت.
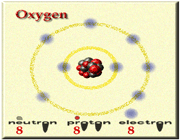
گروه اکسیژن
اتم عناصر ششم (VIA) برای رسیدن به ساختار الکترونی یک گاز نجیب هریک دو الکترون نیاز دارند. روند به دست آوردن الکترون توسط غیرفلزات، مانند از دست دادن الکترون توسط فلزات را میتوان به راه های متفاوت ترسیم کرد. به طور خلاصه غیرفلزات یک، دو یا سه الکترون از فلزات میگیرند و یون منفی ایجاد میکنند این یون های منفی همگی الکترون های والانس جفت شده و آرایش هشت الکترونی پایدار گازهای نجیب را دارند.
فرمول شیمیایی مواد مرکب یونی
فرمول شیمیایی یک ماده مرکب از لحاظ الکتریکی خنثی است. خنثی بودن الکتریکی مستلزم آن است که شمار بارهای مثبت و منفی در بلور ماده مرکب برابر باشند. در بلور نمک طعام یون های با جاذبه الکتریکی میان بارهای مخالف درجای خود نگاه داشته شدهاند.
علاوه بر این برای خنثی بودن این ماده مرکب باید نسبت یون های سدیم به یون های کلرید 1 به 1 باشد. در این صورت سادهترین فرمول آن خواهد بود. در ساختار بلورین هر یون سدیم با هر شش یون کلرید اطراف آن جذب میشود. به همین طریق هر یون کلرید با هر شش یون سدیم اطراف آن جذب میشود در ساختارهای یونی هیچ مولکول تک اتمی وجود ندارد، یعنی هیچ یون خاصی وجود ندارد که منحصرا به یک یون دیگر بپیوندد.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
ویروس(virus)
دیمیتری ایوانووسكی زیستشناس روسی كه دربارهی موزاییك تنباكو كار میكرد، متوجه شد كه عامل بیماری موجود در عصارهی گیاه بیمار از منافذی كه باكتریها نمیتوانند از آنها عبور كنند نیز میگذرد. این مشاهده نظر پاستور را دربارهی موجوداتی كوچكتر از باكتریها اثبات میكرد. سرانجام با اختراع میكروسكوپ الكترونی در یك قرن بعد، دیدن ویروسها برای اولینبار ممكن شد.
ساختار ویروسها
ویروسها ذرات بیجانی هستند كه علیرغم ظاهر متفاوت خصوصیات مشتركی دارند. ابعاد ویروسها عموما از 200 نانومتر كمتر است. بسیاری از ویروسها تخلیص و متبلور میشوند و امكان ذخیره شدن آنها مانند مواد شیمیایی وجود دارد.
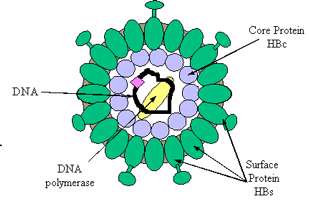
حداقل اجزای هر ویروس یك كپسید و نوكلئیك اسید DNA یا RNA است.
كپسید از زیر واحدهای پروتئینی ساخته شده است. ژنوم ویروس حداكثر چند صد ژن دارد. این درحالی است كه سلول انسانی دارای هزاران ژن است.
پوششی كه اطراف كپسید بعضی از ویروسها وجود دارد در واقع قطعهای از غشای پلاسمایی سلول میزبان است كه دارای بخشهای گلیكو پروتئینی ویروسی است. ویروس پروتئینهای متفاوتی دارد كه بعضی از آنها آنزیم هستند.
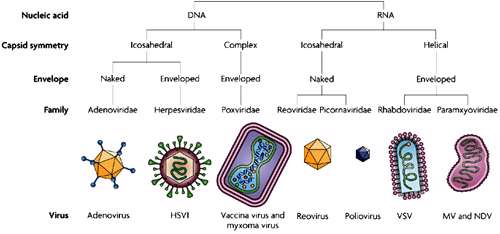
ردهبندی ویروسها
ویروسها براساس موارد زیر ردهبندی میشوند:
1- نوع نوكلئیك اسید
2- اندازه و شكل
3- حضور یا عدم حضور پوشش
از آنجایی كه ویروسها فاقد سلول، واكنشهای سوخت و سازی و تحریكپذیری هستند، آنها را جزو موجودات زنده طبقهبندی نمیكنند.
ویروسها انگلهای اجباری درون سلولی هستند كه نمیتوانند در خارج از سلول زنده تولید مثل كنند.
تولید مثل ویروسها
هر ویروس میزبان اختصاصی خود را دارد. زیرا پروتئینهای كپسید و یا بخشهای گلیكو پروتئینی پوشش در یك الگوی قفل و كلید با گیرندهی سطح سلول میزبان واكنش میدهند.
نوكلئیك اسید ویروسی نیز درون سلول به رمز درمیآید. همچنین ویروس ژنهایی برای تولید آنزیمهای مورد نیاز برای تولید مثل و خروج از سلول میزبان دارد. به هرحال ویروس برای تولید مثل به آنزیمها، ریبوزومها، tRNA و ATP سلول میزبان نیاز دارد. بهعبارتی ویروس هنگام تولید مثل ماشین سوخت و ساز سلول میزبان را به اختیار خود درمیآورد.
باكتریوفاژها (Bacteriophages)
باكتریوفاژها ویروسهایی هستند كه وارد سلولهای باكتری میشوند و آنها را آلوده میكنند. ساختار باكتریوفاژها پیچیده است. كپسید آنها چند وجهی است كه یك دم مارپیچی به آن متصل است. باكتریوفاژ به سطح باكتری متصل میشود و سپس با تخریب دیوارهی سلول باكتری نوكلئیك اسید خود را به درون سلول باكتری تزریق میكند.
چرخهی فعالیت ویروسها
ویروسها دو نوع چرخهی فعال دارند:
الف) چرخهی لیتیك (Lytic Cycle)
ب) چرخهی لیزوژنی (Lysogenic cycle)
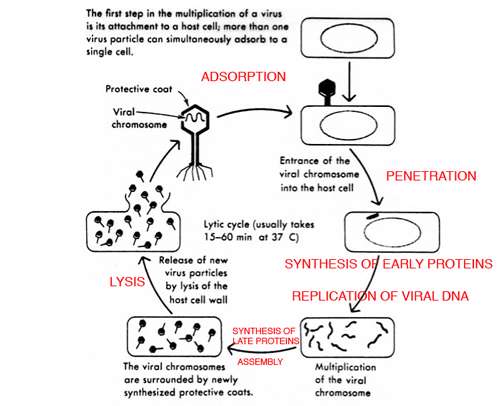
چرخهی لیتیك
در این چرخه ویروس بلافاصله بعد از ورود خود به درون سلول میزبان همانندسازی میكند و با تخریب سلول میزبان از آن خارج میشود.
چرخهی لیتیك به پنج مرحله قابل تفكیك است:
چرخهی لیزوژنی
گاهی ویروسها بعد از ورود به سلول میزبان تا مدتی درون سلول میزبان باقی میمانند؛ در این وضعیت نوكلئیك اسید ویروس وارد ساختار DNA میزبان میشود، بدون اینكه آن را تخریب كند. در این حالت به ویروس پروویروس میگویند. پروویروسها همراه با تقسیم سلول میزبان تقسیم میشوند كه درنتیجهی آن، سلولهای جدید نیز آلوده هستند، عوامل محیطی خاص مانند پرتوهای فرابفنش، سبب میشود كه ویروس وارد چرخهی لیتیك شود.
تولید مثل ویروسها جانوری
ویروس جانوری همانند باكتریوفاژها تولید مثل میكند؛ با این تفاوت كه كپسید آن درون سلول از ژنوم ویروس جدا میشود. همچنین رها شدن ویروسهای جانوری از سلول میزبان با جوانه زدن انجام میشود. هنگام جوانهزدن پوشش ویروس در اطراف آن قرار میگیرد. پوشش ویروس مركب از چربیها، پروتئینها و كربو هیدراتهایی است كه منشا آنها غشای پلاسمایی و یا پوشش هستهی سلول میزبان است.
سایر اجزای پوشش، مانند گلیكو پروتئینهایی كه به ویروس كمك میكنند تا وارد سلول میزبان شود توسط ژنوم ویروس به رمز درمیآیند.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
قزوین
اردبیل
قم
اصفهان
زاهدان
خوزستان
شیراز
جنوب تهران
آبادان
سمنان
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
آيا زمين در یک چاله فضا-زمان واقع شده است؟
تصور يك تصويرگر از فضا-زمان خميده در اطراف زمين
به زودي جواب را به دست خواهيم آورد: آزمايش فيزيكي مشتركی بين سازمان فضايي آمريكا(ناسا) و دانشگاه استنفورد ، به نام “ گرانش کاو
B” (Gravity Probe B)
اخيرا به نخستین نتایج رسیده است. اکنون اولين سال جمع آوري اطلاعات این ماهواره در مدار زمين به پايان رسیده است. نتايج، كه تجزيه و تحليل آنها يك سال ديگر طول خواهد كشيد ، شكل انحنای فضا-زمان را در نزديكي زمين مشخص خواهد كرد.
زمان و فضا –بر طبق نظريه نسبيت اينشتين –به يكديگر بافته شده اند و ساختار تار و پودي چهاربعدي به نام فضا-زمان را به وجود آورده اند.جرم قابل توجه زمين ، اين ساختار را به شكل يك گودي در مي آورد.مانند شخص سنگيني كه وسط يك تشك بادي نشسته باشد (هر چند که چنین خمیدگیهای فضا-زمان را اغلب در محیط اطراف اجرام بسیار پر جرم تر و فشرده تری مانند سیاهچاله ها، ستاره های نوترونی، و کوتوله های سفید سراغ داریم اما اگر با دقت کافی محیط اطراف اجرام بسیار کم جرم تری مانند زمین را نیز بررسی کنیم خمیدگی فضا-زمان ناشی از جرم زمین را می توانیم بیابیم).
بر طبق نظريه نسبيت عام اينشتين ، حركت اجسام در ساختار تار و پودي فضا-زمان صورت مي گيرد. يعني جسم در حال حركت تابع شكل فضا-زماني است كه در آن واقع شده است. بر اساس اين نظريه، گرانش باعث تغيير شكل ساختار فضا-زمان می شود و در نتيجه حركت جسم نيز بر اثر میدان گرانشی تغيير مي كند. مي توان گفت كه به زبان اینشتین گرانش در اصل حركت اجسام در مسير خمیدگی ساختار فضا-زمان در اطراف جسم پرجرم است. یعنی وقتی زمین ر مداری به دور خورشید در گردش است از دید نسبیتی به دلیل انحنای فضا-زمان اطراف خورشید در این مسیر هدایت می شود.
اگر زمين ثابت بود، ضرورتي براي انجام اين كاوش نبود، ولي از آنجا كه زمين به دور خود حركت دوراني دارد ، اين خمیدگی نيز بايد همراه با زمين بچرخد.زمين با پیچ و تاب دادن ساختار فضا-زمان به دور خود به آرامي آن را به صورت يك ساختار چرخشي ۴ بعدي در مي آورد.اين همان چيزي است كه ماهواره گرانش کاو یا
GP-B
براي آزمايش آن به فضا فرستاده شده است.
اين آزمايش براساس فكر بسيار ساده اي انجام مي شود: يك ژيروسكوپ (گردش نما) در حال چرخش در مداري در نزديكي زمين قرار مي دهند ، در حالي كه محور چرخش آن به سمت يك ستاره بسيار دور -در نقش يك مرجع ثابت و بدون حركت- نشانه رفته است. بدون وجود نيروهاي خارجي، محور ژيروسكوپ بايد تا ابد به سمت همان ستاره ثابت بماند.ولي چون فضا-زمان در نزديكي زمين خميده است، جهت محور ژيروسكوپ به مرور زمان تغيير مي كند.با اندازه گيري بسیار دقیق تغييرات جهت محور ژيروسكوپ نسبت به ستاره، مي توان ميزان خميدگي فضا-زمان را در نزديكي زمين اندازه گرفت.
يكي از ژيروسكوپ هاي كاملا كروي در پروژه ماهواره گرانش کاو
اما در عمل این آزمايش بسيار دشوار است:
۴ ژيروسكوپي كه در
GP-B
كار گذاشته شده اند، كامل ترين كره هايي هستند كه تا به حال به دست بشر ساخته شده اند.اين كره ها كه هر کدام به اندازه يک توپ پينگ پونگ اند (به قطر حدود ۴ سانتی متر)، از جنس سيليكون و كوارتز هستند. هيچ گاه اختلاف آنها با يك كره كامل بيش از ۴۰ لايه اتمي نيست. اگر ژيروسكوپ ها كاملا كروي نبودند، محور چرخش آنها حتي بدون اثرات نسبيتي ، حركت مي كرد.
بر طبق محاسبات فضا-زمان انحنا پيدا كرده در نزديكي زمين باعث مي شود تا محور ژيروسكوپ در طول يك سال به اندازه ي ۰.۰۴۱ ثانيه قوس جابه جا شود. يك ثانيه قوس ۳۶۰۰/۱ يك درجه است. براي اندازه گيري دقيق اين زاويه،
GP-B
به دقت سنجش فوق العاده ۰.۰۰۰۵ ثانيه قوس نياز دارد.اين عمل مانند آن است كه بخواهيم قطر يك ورق كاغذ را از فاصله ي ۱۵۰ کیلومتری اندازه بگيريم.
محققان
GP-B
فناوري هاي كاملا جديدي را براي اين اندازه گيري اختراع كرده اند. آنان ماهواره گرانش کاو را کاملا “بدون لرزش” ساخته اند تا در هنگام حركت ماهواره در لايه هاي بالايي جو به ژيروسكوپ ها لرزشي وارد نشود. آنها دريافتند كه چگونه از نفوذ ميدان مغناطيسي زمين به داخل فضاپيما جلوگيري كنند و همچنين دستگاهي را براي اندازه گيري چرخش ژيروسكوپ ، بدون تماس با آن، اختراع كردند.
فرانسيس اوريت ، استاد فيزيك دانشگاه استنفورد و محقق اصلي پروژه
GP-B
مي گويد: “در جريان انجام آزمايش هيچ حادثه غافلگير كننده اي اتفاق نيفتاده است.” اكنون كه مرحله جمع آوري اطلاعات پايان يافته است ، او مي گويد : “دانشمندان
GP-B
با اشتياق و علاقه بيشتري به كار خود ادامه مي دهند و كار سخت پيش روي خود را ناديده نمي گيرند.”
در مرحله بعدي آنها بايد اطلاعات گرفته شده را به طور دقيق و كامل بررسي كنند.اوريت توضيح مي دهد كه دانشمندان GP-B اين كار را در سه مرحله انجام مي دهند: در مرحله اول آنان اطلاعات را به صورت روز به روز بررسي مي كنند تا بي نظمي هاي موجود در آنها را بيابند. سپس اطلاعات را به صورت ماه به ماه در مي آورند و در نهايت آنها را به صورت يك مجموعه كامل به دست آمده در طول يك سال، تحليل مي كنند. بدين ترتيب دانشمندان ايرادات موجود در اطلاعات را ، كه از طريق يك روش تجزيه و تحليل ساده نمي توان پيدا كرد، مي يابند.
نهايتا دانشمندان از سراسر دنيا نتايج را به دقت بررسي مي كنند.اوريت مي گويد: “بدين طريق به سخت ترين منتقدان، اجازه شركت در اين پروژه داده مي شود.” اگر
GP-B
بتواند به طور دقيق چاله فضا-زمانی را كه انتظار مي رود مشخص كند، بدين معني است كه بر اساس باور عمومی فیزیکدانان نظريه اينشتين حقيقت داشته است ولي اگر اين گونه نشود، چه اتفاقي رخ خواهد داد؟ شايد ايرادي در نظريه نسبيت عام اينشتين يافته شود. اختلاف كوچكي كه ظهور انقلابي بزرگ را در فيزيك عصر جديد اعلام خواهد كرد
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تعریف زلزله
برای شناخت هر پدیده ای درجهان واقع لازم است ابتداازآن تعریف مناسب ونسبتاً جامعی داشته باشیم ، چرا که بدون دانستن تعریفی مناسب ازآن نمی توان به کنه پدیده پی برد وآن رابه خوبی درک نمود.
 |
مردم عامی درکلامی ساده زلزله راحرکت ناگهانی زمین ناشی ازخشم نیروهای ماوراء الطبیعه وخدایان می دانند که بر بندگان عاصی وعصیــــــانگر خودکه نافرمانی خداخود را نموده ومرتکب گناهان زیادی شده اند می داننــد .
اگر چه امروزه با گسترش دانش تجربی این تعریف در زمره اباطیل وخرافات قرارگرفته ،ولی هنوز در جوامع ومردم کم دانش وجاهل مورد قبول است.
درفرهنگ تک جلدی عمید زلزله را با فتح حروف « زَ» و « لَ » یعنی زَلزلَه برخلاف آنچه در زبان عامه مردم رایج است ، آورده ومی نویسید :
« زمین لرزه ، لرزش وجنبش شدید ویا خفیف قشر کره زمین که به نقصان درجه حرارت مواد مرکزی واحداث چین خوردگی وفشار یادر اثر انفجارهــای آتشفشانی بوقوع می رسد .»
در فرهنگ جغرافیا تالیف پریدخت فشارکی وهمچنین در فـــــرهــــنـگ جغرافیائی تالیف مهدی مومنی تعریفی مشابه هم به گونه زیر ارائه شده است:
«جنبش یا تکان پوسته زمین که به صورت طبیعی ناشی از زیر پوسته زمین است بعضی وقتها زلزله باعث تغییراتی در سطح زمین می شود ، اما اغلب زیان بوجود آمده ناشی ازتکان ها فقط محسوس است وممکن است زلزله بوسیلــــه یک انفجار آتشفشانی بوجود آید. زلزله در حقیقت در بیشتر نواحی آتشفشانی امری عادی است واغلب قبل ویا همزمان با انفجار اتفاق می افتد . اصل زلزلـــه تکتونیکی است واحتمالاً وجود یک شکست لازمه آن است . موجهای زلزلـــه دست کم در سه جهت اتفاق می افتد ودر یک مسافت قابل ملاحظه از مکــــان اصلی بطور جداگانه حس می شوند . وقتی امواج زلزله ازمکانی می گـــــــذرد زمین وساختمانها می لرزند وبه جلووعقب می روند .بالاترین زیان ناشی اززلزله همیشه در مرکز زلزله یعنی جائی که حرکت بالاوپائین است نیست امـــــــــا در مکانــــهائی که موجهای زلزله بصورت مایل به سطح می رسد ونزدیک مرکــز زلزلــــه باشند دارای بالاترین زیان می باشند .یک زلزله شدید معمولاً بوســـیله یکسری دیــــگر ازتکانها همراه می شود .زلزله ای که که در نزدیک یازیردریا اتفاق مـــــی افتد سبب حرکات شدیدآبها شده وبعضی وقتها امواج بــــــزرگی ازآن ناشی مـــی شود ودر مسافت زیاد این امواج ادامه پیــــدا می کنند وگاهگاهی باعث تلفات جــبران ناپذیر ومرگ ومیرمی شوند .طغیان نواحی ساحلی بیشتراز خود زلزلـــه بــــاعث خسارت می شوند ، در نواحی آتشفشانی زلزله عملاً هر روز اتفاق می افتـــد. به عنوان مثال در هاوائی هرساله صدهاتکانهای کوچک ثبت می شوند .»
 |
|
درفرهنگ گیتا شناسی تالیف عباس جعفری آمده است:
«جنبش سریع ومحسوسی که درنتیجه جابجائی ویا جایگیری تخته سنگهای زیر پوسته زمین پدید می آید،در نتیجه این جنبش یـــــــک سری لرزش های موجی شکل پدید می آیدوگاه تغییرات ارتفاعی پوسته زمین راباعث می گرددواغلب ضایعات وزیان های جانی وفراوانی ازخود برجا میگذارد.زمین لرزه بیشتر مخصوص نواحی آتشفشانی بوده وگاه باخروش وفوران کوههای آتشفشانی همراه می گرددودرحالات شدیدشکستهاوبریدگیهای مهم ومشخص درروی پوسته زمین از خــودبجـــــای
میگذارد.غالب زمین لرزه ها حداقل با سه نوع موج لرزاننده همراه است .در مرکز وقوع زمین لرزه سه موج مزبور بطور همزمان اثرگذارده و ساختمانهاوتأسیسات واقع دراین منطقه را با نوسان های شدید به عقب و جـــــلوومی برد و حد اکثر خسارت و زیان در محلی که امواج مزبور بطور مورب به سطح زمین می رسندوارد می سازد.....»
محمود صداقت درکتاب“ زمین شناسی برای جغرافیا ” تعریفی بدینگونه ارائة می دهد:
«زمین لرزه عبارت است ازحرکات ولرزش های ناگهانی و گذرا در زمین که از ناحیه محدودی منشأ می گیرد و ازآنجا درتمام جهات منتشر می شوند.»
در کتاب فیزیکال جئوگرافی1 آمده است:
«زلزله یکسری ازتکانها ولرزشهای ناگهانی که از آزاد شدن فشار در طول گسل های فعال ودر مناطق آتشفشانی فعال ناشی می شود.تکانها ولرزشهای سطح زمین که در ارتباط با حرکات پوسته زمین در زیر زمین می باشد.»
در فرهنگ آکسفورد آمده است:
«حرکات ناگهانی وشدید سطح زمین.»
از تعاریف ذکر شده در فوق ومنابع دیگر می توان برداشت زیر را نمود:
«زلزله عبارت از حرکات و ارتعاشات نا گهانی سطخ زمین ناشی از شکسته شدن سنگهای پوسته زمین و رها شدن انرژی ذخیره شده در آنها است که در صورت شدت زیاد در مراکز انسانی موجب خسارتهاوزیانهای فراوان می شود.»
زلزله از یکطرف موجب شکسته شدن و جابجائی بین توده های سنگی پوسته زمین می شود و ازطرف دیگر همین جابجائی و شکسته شدن منجر به ایجاد امواج و انتشار در درون زمین می شود ، مانند انداختن قطعه سنگی در حوض یا دریاچه که منجر به ایجاد امواجی می شود.
زلزله مانند شکسته شدن قطعه چوب خشک شده ای می ماند که از یکطرف موجب گسیخته شدن چوب و از طرف دیگر موجب انتشار امواج در اطراف خود می شود.
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
تنوع مورچهها در هر دسته
همه مورچهها دارای زندگی اجتماعی هستند، یعنی مورچهها در دستههای جدا از هم زندگی میکنند. در هر دسته سه نوع مورچه وجود دارد: ملکه که وظیفه آن تخم گذاری و به دنیا آوردن نوزادان است. عدهای مورچههای کارگر هستند که فاقد بال میباشند و کار آنها جمعآوری دانهها و مواد غذایی و حفر لانه و نگهداری تخمها و نوزادان میباشد. تعداد کمی از افراد .....................
برای دیدن مطلب روی ادامه مطلب کلیلک کنید
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
برخی از خوراکیها به طور چشمگیری سطح انرژی بدن را بالا میبرند. افزایش انرژی به طور طبیعی روحیه را بهبود میبخشد.
سعی کنید از این پنج خوراکی برای بالا بردن روحیه خود استفاده کنید چرا که سطح قند خونتان را بالا میبرند و با داشتن کالری کم، منجر به افزایش وزن نیز نمیشوند.
بادام
بادام غنی از مواد معدنی و ویتامینها، از جمله منگنز، مس، ویتامین۲ B و فسفر است.
منیزیم یه عنوان یک ماده معدنی که نقش اساسی در تولید انرژی و سیستم ایمنی بدن دارد میتواند الگوی خواب را بهبود بخشد، عضلات را شل کند، تنش و اضطراب را برطرف کرده و مانع افزایش افسردگی شود.
پروتئین و فیبر موجود در بادام قند خون را تثبیت می کند و زمانی که قند خون افت میکند برای تنظیم انرژی سوزانده میشود. چربیهای سالم مثل انواع موجود در بادام برای محدود کردن اشتها و جلوگیری......
جهت مشاهده روی ادامه مطلب کلیک کنید
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:
آرژانتین: سرزمین نقره (اسپانیایی)
آفریقای جنوبی: سرزمین بدون سرما / آفتابی جنوبی (لاتین، یونانی)
آلبانی: سرزمین كوه نشینان
آلمان: سرزمین همه مردان یا قوم ژرمن (فرانسوی، ژرمنی)
آنگولا: از واژه نگولا كه لقب فرمانروایان محلی بود
اتریش: شاهنشاهی شرق (ژرمنی)
اتیوپی: سرزمین چهره سوختگان (یونانی)
ازبكستان: سرزمین خودسالارها (سغدی، تركی، فارسی دری)
اسپانیا: سرزمین خرگوش كوهی (فنیقی)
استرالیا: سرزمین جنوبی (لاتین)
و...........
جهت مشاهده روی ادامه ی مطلب کلیک کنید
موضوعات مرتبط: مطالب علمی ، ،
برچسبها:













 آمار
وب سایت:
آمار
وب سایت:

